
| A.室温下,0.1mol·L-1的CH3COONa溶液的pH=8 |
| B.室温下,0.1mol·L-1的CH3COOH溶液的pH="3" |
| C.醋酸中加水后,溶液的pH升高 |
| D.0.1mol·L-1的CH3COOH导电能力不如0.1mol·L-1的盐酸强 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三者浓度相同时,pH大小顺序为③>②>① |
| B.三者浓度相同时,稀释相同倍数,pH变化最大的为② |
| C.三者的pH均为9时,物质的量浓度的大小关系为③>②>① |
| D.三者浓度相同时,分别加入同体积同浓度的盐酸后,pH最大的是① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3COONa晶体 |
| B.氨水 |
| C.0.1mol/L H2SO4溶液 |
| D.0.01mol/L CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
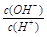 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
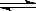 CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )
CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是( )| A.NH4Cl固体 | B.CH3COONa | C.NH3·H2O | D.Zn粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通过测浓度均为0.01 mol/L的溶液的pH大小来鉴别盐酸和乙酸? |
| B.向均含石蕊的盐酸和乙酸溶液中分别加入NaCl、CH3COONa来鉴别盐酸和乙酸是否为弱电解质? |
| C.加热蒸发FeCl3溶液制备FeCl3晶体? |
| D.测均为0.1 mol/L的NaCl、CH3COONa溶液的pH来鉴别盐酸和乙酸是否为弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com