
【题目】能正确表示下列反应的离子方程式的是
A.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑
D.一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:
2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】人生病时要合理用药。下列药品与其作用不匹配的是
A. 氢氧化铝:中和过多胃酸 B. 阿司匹林: 解热镇痛
C. 青霉素:消炎抗菌 D. 医用碘酒:人体补碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内虽很少,却是维持正常生命活动不可缺少的,这可以通过下面哪一实例得到说明
A. Mg是叶绿素的组成成分
B. 油菜缺少硼时会出现“花而不实”
C. 动物血液钙盐含量太低会抽搐
D. 缺P会影响ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法制备胶体:①0.5 mol/L的BaCl2溶液和等体积2 mol/L的硫酸混合振荡;②把1 mol/L饱和的FeCl3溶液逐滴加入20 mL沸水中,边加边振荡;③1 mol/L NaOH溶液滴
到1 mol/L FeCl3溶液中,可行的是( )
A.①② B.①③
C.② D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关碰撞理论,下列说法中正确的是 ( )
A. 具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B. 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大
C. 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D. 催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1所示),并测定电离平衡常数Kb。
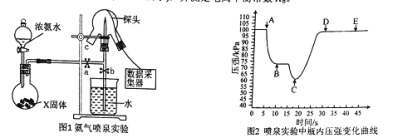
(1)实验室可用浓氨水和X固体制取NH3 , X固体可以是 。
A.生石灰 B.无水氯化钙 C.五氧化二磷 D.碱石灰
(2)检验三颈瓶集满NH3的方法是: 。
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口, ,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2所示。图2中 点时喷泉最剧烈。
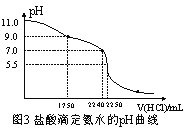
(4)从三颈瓶中用 (填仪器名称)量取20.00 mL氨水至锥形瓶中,用 0.05000 mol/L HCl滴定。用pH计采集数据、电脑绘制滴定曲线如图3所示。
(5)据图3计算,当pH =11. 0 时,NH3H2O电离平衡常数Kb的近似值,Kb≈ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5·H2O, 硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程如下:

回答下列有关问题:
(1)硼砂中B的化合价为__________,溶于热水后,常用H2SO4调pH到2~3制取H3BO3,反应的离子方程式为__________________。
(2)氧化物X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为______________,该反应中的氧化剂是(填化学式)_______________。
(3)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,这一变化的化学方程式为____________________。皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,则硼酸与氢氧化钠反应的离子方程式为 。
(4)MgCl2·7H2O需要在HCl氛围中加热制MgCl2,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
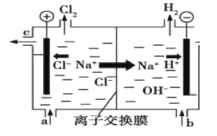
(1)写出电解饱和食盐水的离子方程式 。
(2)离子交换膜的作用为 : 、 。
(3)精制饱和食盐水从图中__________位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
(5)室温下,0.1mol/LNaClO溶液的pH 0.1 mol/LNa2SO3溶液的pH。(选填“大于”、“小于”或“等于”)
(6)浓度均为0.1mol/L的N2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为 。
(7)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
①联氨分子的电子式为 。
②实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com