
【题目】除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液
D. 滤液加稀盐酸时只发生反应:H+ +OH- =H2O
【答案】D
【解析】
除去混合物中的可溶性杂质,常将杂质离子转化为难溶物,再过滤。为保证除杂完全,所用沉淀剂必须过量。而过量的沉淀剂应在后续步骤中除去。据此分析解答。
A、粗盐中的杂质离子为Ca2+、Mg2+和SO42-,可分别用过量的Na2CO3、NaOH、BaCl2溶液将其转化为沉淀,选项A正确;
B、多余的Ba2+可用Na2CO3去除,故Na2CO3溶液需在BaCl2溶液之后加入,选项B正确;
C、为防止某些沉淀溶解于盐酸,则加入稀盐酸前应进行过滤。检验SO42-时,先加稀盐酸酸化,再加BaCl2溶液,观察是否有白色沉淀,选项C正确;
D、多余的CO32-、OH-可用稀盐酸去除,选项D错误。
答案选D。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】“治污水”是“五水共治”工程中一项重要举措。
(1)某污水中的有机污染物为三氯乙烯 (C2HCl3),向此污水中加入一定浓度的酸性重铬酸钾(K2Cr2O7还原产物为Cr3+)溶液可将三氯乙烯除去,氧化产物只有CO2。写出该反应的离子反应方程式_____。
(2)化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样的COD。主要的实验装置、仪器及具体操作步骤如下:
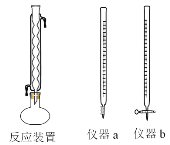
操作步骤:
Ⅰ量取20.00mL水样于圆底烧瓶中,并加入数粒碎瓷片;Ⅱ量取10.00mL重铬酸钾标准溶液中加入到圆底烧瓶中,安装反应装置(如上图所示)。从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应后停止加热。Ⅲ待反应液冷却后加入指示剂2滴,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。发生的化学反应方程式为Cr2O72-+14H++6Fe2+=6Fe3++2Cr3++7H2O。请回答:
①量取10.00mL重铬酸钾标准溶液用到的仪器是_______________(填仪器a或仪器b)。
②下列有关说法正确的是 _________________(用相应编号填写)。
A. 配制重铬酸钾标准溶液时所有需用到仪器有:天平(含砝码)、玻璃棒、烧杯和容量瓶
B. 滴定前锥形瓶、滴定管均需用蒸馏水洗后再用待取液进行润洗
C. 滴定时用左手控制旋塞,眼睛注视锥形瓶内液体颜色变化,右手摇动锥形瓶,使溶液向同一方向旋转
D. 加热回流结束后,未用蒸馏水冲洗冷凝管管壁,则滴定测得的硫酸亚铁铵体积偏小
③已知:重铬酸钾标准溶液的c(Cr2O72-)=0.02000mol·L-1,硫酸亚铁铵溶液的c(Fe2+)=0.01000 mol·L-1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为18.00mL,则按上述实验方法,测得的该水样的化学需氧量COD=_______mg/L。
(3)工业上常用铁炭(铁屑和活性炭混合物)微电解法处理污水。保持反应时间等条件不变,测得铁碳混合物中铁的体积分数、污水溶液pH对污水COD去除率的影响分别如图1、图2 所示。
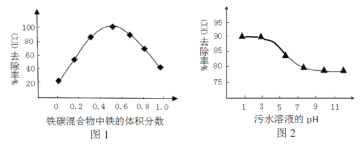
①由图1、图2可知下列推论不合理的是________________。
A. 活性炭对污水中的还原性物质具有一定的吸附作用
B. 酸性条件下,铁屑和活性炭会在溶液中形成微电池,铁为负极,溶液中有大量的Fe2+、Fe3+
C. 当铁碳混合物中铁的体积分数大于50%时,COD的去除率随着铁的质量分数增加而下降的主要原因是溶液中微电池数目减少
D. 工业降低污水COD的最佳条件为:铁的体积分数占50%;污水溶液pH约为3
②根据图2分析,COD的脱除率降低的原因可能为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
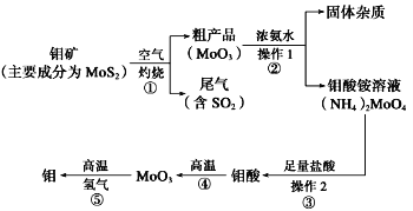
(1)写出在高温下发生反应①的化学方程_____
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:___
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_____
(4)某同学利用如图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:

①步骤⑤的化学反应方程式为___。请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是____。
②在烧瓶A中加入少量硫酸铜的目的是__
③两次使用D装置,其中所盛的药品依次是_____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是在实验室进行氨气快速制备与性质探究实验的组合装置,部分固定装置未画出。
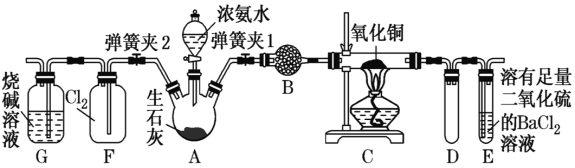
(1)装置B中盛放的试剂是________________。装置D的作用是____________。
(2)点燃C处酒精灯,并闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗活塞,稍等片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生白色沉淀,从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:__________________________。E中发生反应的离子方程式:________。
(3)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16g,反应后固体质量减少2.4g,通过计算确定该固体产物的成分______________________________(用化学式表示)。
(4)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:________________,迅速产生倒吸的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 MnO2是一种重要的无机功能材料,工业上提纯粗MnO2(含有较多的MnO和MnCO3)实验工艺流程如下图,则下列说法不正确的是
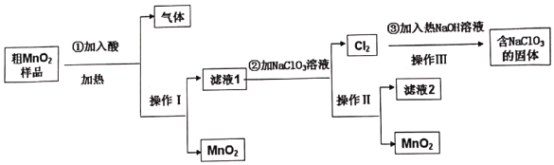
A.若①加入的是稀H2SO4,实际生产中可由滤液2进一步制得副产品Na2SO410H2O
B.操作Ⅲ是减压蒸发,理论上得到的固体NaCl和NaClO3物质的量之比为5:1
C.①加酸的目的是溶解MnO和MnCO3,实际生产可以用浓盐酸进行溶解
D.②反应的离子方程式:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
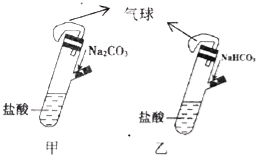
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林铜具有很强的抗炎作用。它是一种亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂中。易受热分解成浅绿色混合物。在强酸条件下能解离出铜离子。合成阿司匹林铜,其实验流程如下:
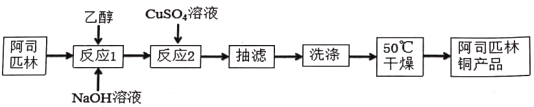
已知反应方程式如下:
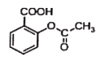 +NaOH→
+NaOH→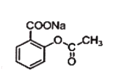 +H2O
+H2O
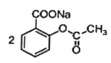 +CuSO4→
+CuSO4→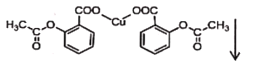 +Na2SO4
+Na2SO4
(1)下列有关说法正确的是_____。
A.反应1中加乙醇作溶剂,目的是增大接触面积,加快反应速率
B.用倾析法将反应2中的液体和沉淀同时转移到布氏漏斗中进行抽滤
C.洗涤操作中,可先用水洗2-3次,再用酒精洗涤2-3次
D.干燥后发现固体呈浅绿色,可能是烘干温度过高造成的结果
(2)反应1中的反应温度要求控制在室温的理由是______。
(3)阿司匹林铜中铜含量的测定,可用碘量法测定:
步骤一:准确称取0.800g样品,置于250mL锥形瓶中,加4mL3.00mol/L,再加20mL水,加热煮沸,样品完全分解后,摇匀,冷却到室温。
步骤二:往溶液中加入1.200gKI摇匀,用0.100mol/LNa2S2O3标准溶液滴定至溶液变浅黄色时,加入10mL 10% KSCN试剂,并加几滴淀粉溶液,继续用0.100mol/LNa2S2O3标准溶液滴定至终点,共消耗溶液体积为23.00mL。
已知:CuI难溶于水,能吸附碘;I2+2S2O32-=S4O62-+2I-。
CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①实验中加入10mL 10%KSCN试剂的目的是______。
②上述测定实验中,继续滴加Na2S2O3标准溶液至终点的具体实验操作______。
③该样品中的铜含量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学、环境保护和人类健康是息息相关的三个主题,请根据已知信息回答有关问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是________(填序号)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl→CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性高的是________反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性酸根离子氧化除去。请写出用ClO2将废水中有剧毒的CN-氧化成无毒气体的离子方程式:____________________并说明该方法的优点:_____________________________________。
(3)如图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
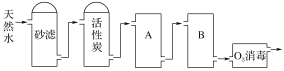
活性炭的作用是____________________;用O3消毒的优点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图①—⑩分别代表有关反应中的一种物质,其中③气体能使酚酞试液变红,⑦是红综色气体,回答:

(1)①中的混合气体通过浓硫酸发生化学反应,主要生成物的化学式是____。
(2)写出碳酸氢铵中阳离子的检验方法______________________________。
(3)写出工业上合成③的化学方程式__________________________________。
(4)⑧与⑨反应的化学方程式是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com