
加热N2O5,依次发生分解反应:①N2O5(g) N2O3(g)+O2(g)、②N2O3(g)
N2O3(g)+O2(g)、②N2O3(g) N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5,加热到T℃时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T℃时
N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5,加热到T℃时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T℃时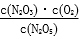 为
为
A.10.7 B.8.5 C.9.6 D.10.2
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
单晶硅是制作电子集成电路的基础材料。一个电脑芯片上如果集成10亿个晶体管, 其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化
其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化 学方法可制得高纯度硅,其化学方程式为:①SiO2 + 2C
学方法可制得高纯度硅,其化学方程式为:①SiO2 + 2C  Si + 2CO;②Si + 2Cl2
Si + 2CO;②Si + 2Cl2  SiCl4;③SiCl4 +2H2
SiCl4;③SiCl4 +2H2  Si + 4HCl,其中,反应①和③属于
Si + 4HCl,其中,反应①和③属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:实验题
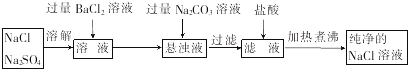
粗盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯;② 固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为________________。
(2)该实验中加入除杂质试剂的顺序不正确的是_____________
A.NaOH BaCl2 Na2CO3
B.BaCl2 Na2CO3、 NaOH
C.BaCl2 NaOH Na2CO3
D.Na2CO3、 NaOH BaCl2
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:____________________________________;
过滤时:____________________________________;
蒸发时:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
下列实验操作中错误的是
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸发结晶时应将溶液蒸干
C. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
D. 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A. 玻璃棒 B. 胶头滴管 C. 试管 D. 漏斗
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol 的CuSO4(s)溶于水会使溶液温度升高, 热效应为ΔH2,CuSO4·5H2O 受热分解的化学方程式为:CuSO4·5H2O(s)
热效应为ΔH2,CuSO4·5H2O 受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
A.ΔH2>ΔH3 B .ΔH1>ΔH3
.ΔH1>ΔH3
C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
已知:C(s)+H2O(g)===CO (g) +H2 (g) ΔH=a kJ·mol-1
2C(s)+ O2(g)===2CO (g) ΔH= - 220 kJ·mol-1
H-H、O==O和O- H键的键能分别为436、496和462 kJ·mol-1,则 a 为
H键的键能分别为436、496和462 kJ·mol-1,则 a 为
A.-332 B.+130 C.+350 D.-118
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| 另取少量滤液,滴入适量盐酸 | 若出现气泡 | 滤液中含Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.
如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com