
【题目】近年,一些药物引起的不良反应引起了人们的关注。因此在开发新药时如何减少毒副作用是一个很重要的课题。在下列结构简式中,Ⅰ是扑热息痛,Ⅱ是阿司匹林,它们都是临床应用广泛的解热镇痛药,但Ⅰ易导致肾脏中毒,Ⅱ对胃黏膜有刺激性,多用会引起胃溃疡。Ⅲ是扑炎痛,它是根据药物合成中“拼合原理”的方法,设计并合成出的解热镇痛药。这三种物质的结构简式如下:
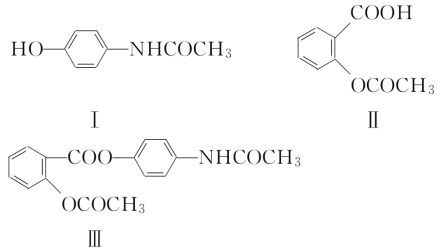
试回答:
(1)为什么阿司匹林会有上述的毒副作用?___________
(2)合成扑炎痛的反应属于有机化学中的哪一类反应?_________
(3)扑炎痛本身并无解热镇痛的功效,但口服进入人体内后会产生上述药理作用,且毒副作用没有Ⅰ和Ⅱ那么明显,试加以解_______________
【答案】由于阿司匹林中含有羧基,显酸性(包括水解作用产生的酸) 酯化反应 扑炎痛在体内(在酶的作用下)水解变成Ⅰ和Ⅱ,因此起到解热镇痛的作用;同时,比单独服用Ⅰ和Ⅱ的药剂量减少了至少一半,故降低了毒副作用
【解析】
本题主要考查肽键结构(—CO—NH—)和酯基结构(—COO—)的化学性质,两者共同的特点是都能水解生成酸。
(1) 由于阿司匹林有羧基,显酸性(包括水解作用产生的酸),因此阿司匹林会有上述的毒副作用;
(2)根据结构可知:扑炎痛可看作是由扑热息痛和阿司匹林通过酯化)或取代)反应生成的;
(3)扑炎痛含有酯基可水解,在体内(酶的作用下)水解变成Ⅰ和Ⅱ,因此显效,同时,比单独服用Ⅰ和Ⅱ时的药剂量起码减少了一半,故Ⅰ和Ⅱ的毒副作用都降低了。


科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
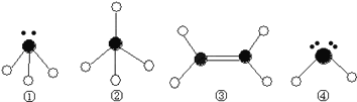
则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铁、盐酸、氧气、水、硝酸银溶液五种物质中选出一种或两种作反应物,按下列要求的反应类型各写一个化学方程式。
(1)化合反应_______;
(2)分解反应________;
(3)置换反应________;
(4)复分解反应_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-浓度相等的是( )
A. 150 mL 1 mol·L-1的NaCl溶液B. 75 mL 2 mol·L-1NH4Cl溶液
C. 150 mL 2 mol·L-1的KCl溶液D. 100 mL 1.5mol·L-1的MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol
H2O(g)+CH3OH(g) △H=-53.7kJ/mol
(1) 308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。


①反应开始至达平衡时,υ(H2)=________;该温度下反应的平衡常数为______mol-2·L2。
②若只改变某一条件,其他条件相同时,曲线变化为II,则改变的条件是____。
(2)还可以通过以下途径实现CO2向CH3OH的转化:
反应I:CO2(g)+H2(g)![]() H2O(g)+CO(g) △H<0
H2O(g)+CO(g) △H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
反应I和反应Ⅱ的平衡常数K随温度T的变化如图2所示。
①根据图中数据分析可知,T1____T2(填“>”、“<”或“=”);T2时CO2转化为CH3OH的平衡常数K=_______;
②目前,许多国家采用CO2代替CO(以煤和天然气为原料)生产CH3OH,其优点是_________。
(3)用电解法可将CO2转化为多种燃料,原理如图3。铜电极上产生HCOOH的电极反应式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 以下是日常生活中常见的一些物质:①液氯、②酒精、③CO2、④熟石灰、⑤碳酸钠、⑥稀盐酸、⑦CaO、⑧Na2O2、⑨Cu,请你指出(填写序号):
(1)属于碱性氧化物的是______;能导电的是________。
(2)⑤在水中的电离方程式为____________。
(3)根据以上物质写出一个酸性氧化物与碱溶液反应的离子方程式: __________。
II. 化学计量在化学中占有重要地位.根据计算填空:
(1)1.204×1022个HCl分子的物质的量为______,该气体溶于水配制成500 mL的溶液,则溶液中Cl﹣的物质的量浓度为______。
(2)标准状况下体积为44.8LSO2与______g H2所含的分子数相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲型H1N1流感病毒曾在全球广泛传播,给人类健康、社会经济带来了巨大的负面影响。我国采取积极应对措施,使病毒得到了有效的控制,从很大程度上减少了损失,在这里,消毒液功不可没。
(1)生产消毒液是将氯气通入NaOH溶液中,该反应的离子方程式为________。
(2)取少量消毒液滴加AgNO3溶液,现象是出现白色沉淀,说明消毒液中有____离子(写离子符号),该反应的的离子方程式为____________。
(3)消毒液稀释后喷洒在空气中,可以生成具有漂白性的物质,该物质为_________;该物质有漂白性是因为它有强的氧化性,但是它也很不稳定,写出它分解反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L容器中用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)![]() 2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A. 0~2 min的反应速率小于4~6 min的反应速率
B. 2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C. 增大压强可以提高HCl转化率
D. 平衡常数K(200 ℃)<K(400 ℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨负极(C)、LiFePO4正极组成的锂离子电池的工作原理如图所示(实际上正负极材料是紧贴在锂离子导体膜两边的)。充放电时,Li+在正极材料上脱嵌或嵌入,随之在石墨中发生了LixC6生成与解离。下列说法正确的是

A. 锂离子导电膜应有保护成品电池安全性的作用
B. 该电池工作过程中Fe元素化合价没有发生变化
C. 放电时,负极材料上的反应为6C+xLi++ xe- =LixC6
D. 放电时,正极材料上的反应为LiFePO4 - xe- = Li1-xFePO4 + xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com