
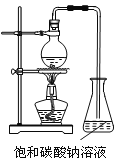
【题目】下图是实验室进行氯气的制备及性质实验的组合装置,部分固定装置未画出。
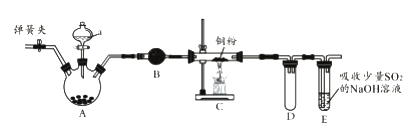
(1)A中固体是氯酸钾,液体a是浓盐酸,写出该反应的化学方程式:_________________。
(2)B为干燥装置,加入的固体是_________________;欲净化氯气,A、B间应添加一个盛有_________________的洗气瓶。
(3)C中的反应现象是_________________;D的作用是_________________。
(4)已知E中发生的反应为:Cl2+Na2SO3+2NaOH![]() 2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
a.甲同学认为该吸收液中ClO-和SO32-不能同时存在,其理由是_________________(用离子方程式表示)。
b.乙同学为了检验吸收液中是否含有SO32-,取少量吸收液于试管中,加适量稀硫酸酸化后,滴加品红溶液,发现品红溶液褪色。据此推断该吸收液中一定有SO32-。乙同学的推断是否正确?________________(填“正确”或“不正确”),理由是_________________。
c.请设计实验检验吸收液中是否含有ClO-_______________(写出实验步骤、现象和结论)。
【答案】KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O五氧化二磷 (或其他合理答案)饱和食盐水生成棕黄色的烟安全瓶(或防倒吸)ClO-+SO32-=Cl-+SO42-不正确HClO具有漂白性,也能使品红溶液褪色取少量吸收液,加入适量稀硫酸酸化,再加入几滴石蕊溶液,若溶液先变红后褪色,则原溶液中含有ClO-;若溶液变红且不褪色,则原溶液中不含ClO-
【解析】(1)固体氯酸钾与浓盐酸混合可生成氯化钾和氯气,根据电子守恒和原子守恒,发生反应的化学方程式为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
(2)浓盐酸具有挥发性,制备的氯气中含有氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,选择盛有饱和食盐水洗气瓶除去氯化氢,五氧化二磷为酸性干燥剂,与氯气不反应,可以干燥氯气;
(3)在加热条件下Cu遇氯气,剧烈燃烧,产生棕黄色的烟;因氯气易溶于NaOH溶液,为防止产生倒吸现象,选择D装置作安全瓶;
(4)a.因ClO-有强氧化性,而SO32-有较强还原性,二者易发生反应ClO-+SO32-=Cl-+SO42-,则吸收液中不可能同时存在ClO-和SO32-;
b.因吸收液中可能存在ClO-,在酸性条件下HClO有漂白性,也能使品红褪色,故乙同学的推断不正确;
c.为检验吸收液中是否含有ClO-,可取少量吸收液,加入适量稀硫酸酸化,再加入几滴石蕊溶液,若溶液先变红后褪色,则原溶液中含有ClO-;若溶液变红且不褪色,则原溶液中不含ClO-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为周期表中前四周期的元素。请按要求回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
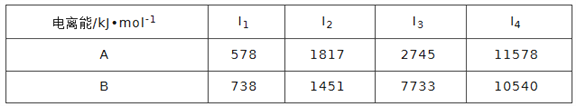
下列有关A、B的叙述不正确的是(____)a.离子半径A<B b.电负性A<B
c.单质的熔点A>B d.A、B的单质均能与氧化物发生置换
e.A的氧化物具有两性 f.A、B均能与氯元素构成离子晶体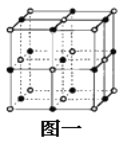
(2)C是地壳中含量最高的元素,C基态原子的电子排布式为_______。Cn-比D2+少l个电子层。二者构成的晶体的结构与NaCl晶体结构相似(如图一所示),晶体中一个D2+周围和它最邻近且等距离的D2+有_____个。
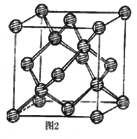
(3)E元素原子的最外层电子数是其次外层电子数的2倍,则乙酸分子中E原子的杂化方式有_____。E的一种单质其有空间网状结构,晶胞结构如图2。己知位于晶胞内部的4个原子,均位于体对角线的1/4或3/4处,E-E键长为apm,则E晶体的密度为_________g/cm3(用含有NA、a的式子表示)。
(4)F与硒元素同周期,F位于p区中未成对电子最多的元素族中,F的价电子排布图为
______,FO33-离子的空间构型为__________;F第一电离能_______硒元素(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从以上表格中判断以下说法中不正确的是
A.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO![]()
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中这四种酸都没有完全电离
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应: CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有_______________、__________________等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为_______________、_______________等。
(3)此反应以浓硫酸为催化剂,可能会造成________________、_______________等问题。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年9月4日辽宁阜新市清河口区河西镇八矿,井下发生了瓦斯爆炸事故,事故共造成14人死亡,2人下落不明。实验证明,瓦斯中CH4和O2的体积比为1∶2时爆炸威力最大,则此时CH4和O2的质量比为
A.1∶1
B.1∶2
C.1∶4
D.2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届河北省定州中学高三上期末】下图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是

A.拆开2molH2 (g)和1 molO2 (g)中的化学键成为H、O原子,共放出1368 kJ能量
B.由H、O原子形成2 molH2O(g),共吸收1852 kJ能量
C.2 molH2 (g)和1 molO2 (g)反应生成2 molH2O(1),共吸收484 kJ能量
D.2 molH2 (g)和1 molO2 (g)反应生成2 moIH2O(g),共放出484 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、生石膏、冰醋酸、氯化银
④同素异形体:C60、C70、金刚石、石墨
A.①③ B.②③ C.③④ D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com