
”¾ĢāÄæ”æĆ÷·ÆŹÆŗĶ¼īŹ½Ģ¼ĖįĀĮĆ¾[MgaAlb£ØOH£©c£ØCO3£©dxH2O]ŌŚÉś²śÉś»īÖŠ¶¼ÓŠ×ż«ĪŖÖŲŅŖµÄÓ¦ÓĆ£®Ä³ŃŠ¾æŠ”×é¶ŌÓĆĆ÷·ÆŹÆÖĘČ”ĒāŃõ»ÆĀĮµČĪļÖŹ£¬ŅŌ¼°¼īŹ½Ģ¼ĖįĀĮĆ¾µÄ×é³ÉÕ¹æŖĮĖČēĻĀŃŠ¾æ£¬ĒėÄć²ĪÓė²¢Ķź³É¶ŌÓŠ¹ŲĪŹĢāµÄ½ā“š
£Ø1£©Ć÷·ÆŹÆŹĒÖĘČ”»Æ·ŹŗĶĒāŃõ»ÆĀĮµÄÖŲŅŖŌĮĻ£¬Ć÷·ÆŹÆµÄ×é³ÉŗĶĆ÷·ÆĻąĖĘ£¬“ĖĶā»¹ŗ¬ÓŠŃõ»ÆĀĮŗĶÉŁĮæŃõ»ÆĢśŌÓÖŹ£®¾ßĢåŹµŃé²½ÖčČēĶ¼1ĖłŹ¾£ŗ 
¢Ł²Ł×÷IµÄĆū³ĘĪŖ
¢Ś»ģŗĻ·ŹĮĻµÄÖ÷ŅŖ³É·ÖŹĒ£ØŠ“»ÆѧŹ½£©£®¼ģŃéĀĖŅŗ¢ņÖŠŹĒ·ńŗ¬ÓŠNH4+µÄ·½·ØŹĒ£ŗȔɣ»õĀĖŅŗ¢ņÓŚŹŌ¹ÜÖŠ£¬ĻņĘäÖŠ¼ÓČėŹŹĮæµÄNaOHČÜŅŗ£¬¼ÓČČ£¬Čō²śÉśĘųĢåÄܹ»Ź¹ £¬ ŌņÖ¤Ć÷ĀĖŅŗ¢ņÖŠŗ¬ÓŠNH4+
¢ŪŅ»¶ØĢõ¼žĻĀ£¬ĻĀĮŠĪļÖŹÄÜÓė³Įµķ¢ņ·¢Éś·“Ó¦µÄŹĒ£ØĢī×ÖÄø£©
a£®KSCN ČÜŅŗ b£®Al c£®NaOH ČÜŅŗ
¢ÜæÕĘųÄܹ»ĪŖ³Įµķ·“Ó¦Ģį¹©×ćĮæµÄ£ØŠ“»ÆѧŹ½£©£®
£Ø2£©¼īŹ½Ģ¼ĖįĀĮĆ¾ŹĒ³£¼ūĪøŅ©”°“ļĻ²”±µÄÖ÷ŅŖ³É·Ö£®ĪŖČ·¶Ø¼īŹ½Ģ¼ĖįĀĮĆ¾µÄ×é³É£¬½ųŠŠĮĖČēĻĀŹµŃé£ŗ
¢ŁČ”¼īŹ½Ģ¼ĖįĀĮĆ¾·ŪÄ©6.02g£¬»ŗ»ŗ¼ÓČė2.0molL©1ŃĪĖįŹ¹Ęä³ä·Ö»ģŗĻ·“Ó¦£¬·“Ó¦¹ż³ĢÖŠ²śÉśĘųĢåµÄĢå»żV£ØĘųĢ壩ŗĶĻūŗÄŃĪĖįµÄĢå»żV£ØHC1£©µÄ¹ŲĻµČēĶ¼2ĖłŹ¾£¬Ōņ¼īŹ½Ģ¼ĖįĀĮĆ¾ÖŠĒāŃõøłÓėĢ¼ĖįøłµÄĪļÖŹµÄĮæÖ®±ČĪŖ
¢Ś½«¢Ł·“Ó¦ŗóµĆµ½µÄ»ģŗĻŅŗŌŁŗĶ¹żĮæµÄĒāŃõ»ÆÄĘČÜŅŗ³ä·Ö»ģŗĻ£¬·“Ó¦ĶźČ«ŗó¾¹ż¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµĆ³Įµķ3.48g£¬Ōņ¼īŹ½Ģ¼ĖįĀĮĆ¾µÄ»ÆѧŹ½ĪŖ £® 
”¾“š°ø”æ
£Ø1£©ĄäČ“½į¾§£»K2SO4”¢£ØNH4£©2SO4£»ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶£»b£»CO2
£Ø2£©16£ŗ1£»Mg6Al2£ØOH£©16CO3?4H2O
”¾½āĪö”æ½ā£ŗ£Ø1.£©Ć÷·ÆŹÆŗ¬ÓŠAl2O3ŗĶFe2O3µČŌÓÖŹ£¬¼Ó×ćĮæµÄĻ”°±Ė®£¬Ć÷·ÆŹÆÖŠµÄĀĮĄė×ÓÓė°±Ė®·“Ó¦£¬¹żĀĖŗó³ĮµķIÖŠŗ¬Al2O3”¢Fe2O3”¢Al£ØOH£©3 £¬ ČÜŅŗIÖŠŗ¬¼ŲĄė×Ó”¢ļ§øłĄė×Ó”¢ĮņĖįøłĄė×Ó£¬ĀĖŅŗ¾¹żÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖµĆµ½ĮņĖį¼Ų”¢ĮņĖįļ§¾§Ģ壮Al2O3”¢Fe2O3”¢Al£ØOH£©3ÖŠ¼ÓČėĒāŃõ»ÆÄĘ£¬Fe2O3ÓėĒāŃõ»ÆÄĘ²»·“Ó¦£¬Al2O3”¢ĒāŃõ»ÆĀĮÓėĒāŃõ»ÆÄĘ·“Ó¦£ŗAl£ØOH£©3+NaOHØTNaAlO2+2H2O£¬Al2O3+2NaOHØT2NaAlO2+H2O£¬ĀĖŅŗÖŠŗ¬ÓŠNaAlO2ČÜŅŗ£¬³Įµķ¢ņĪŖŃõ»ÆĢś£¬ĀĖŅŗÖŠĶØČė×ćĮæµÄæÕĘų£¬·¢Éś·“Ó¦£ŗNaAlO2+CO2+2H2O=Al£ØOH£©3”ż+NaHCO3 £¬ ŌŁ¹żĀĖµĆµ½ĒāŃõ»ÆĀĮ£¬ČÜŅŗ¢óÖŠŗ¬ÓŠNaHCO3 £® ¢Ł²Ł×÷IŹĒ“ÓČÜŅŗÖŠ»ńµĆ¾§Ģ壬ŠčŅŖ½į¹¹Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖµČ²Ł×÷£¬¹Ź“š°øĪŖ£ŗĄäČ“½į¾§£»¢ŚÓÉÉĻŹö·ÖĪöæÉÖŖ£¬»ģŗĻ·ŹĮĻµÄÖ÷ŅŖ³É·ÖŹĒK2SO4”¢£ØNH4£©2SO4 £¬ ¼ģŃéĀĖŅŗ¢ņÖŠŹĒ·ńŗ¬ÓŠNH4+µÄ·½·ØŹĒ£ŗȔɣ»õĀĖŅŗ¢ņÓŚŹŌ¹ÜÖŠ£¬ĻņĘäÖŠ¼ÓČėŹŹĮæµÄNaOHČÜŅŗ£¬¼ÓČČ£¬Čō²śÉśĘųĢåÄܹ»Ź¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶£¬ŌņÖ¤Ć÷ĀĖŅŗ¢ņÖŠŗ¬ÓŠNH4+ £¬ ¹Ź“š°øĪŖ£ŗK2SO4”¢£ØNH4£©2SO4£»ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶£»¢Ū³Įµķ¢ņĪŖŃõ»ÆĢś£¬AlÄÜÓėŃõ»ÆĢś·¢ÉśĀĮČČ·“Ó¦£¬¹ŹŃ”£ŗb£»¢ÜæÕĘųÄܹ»ĪŖ³Įµķ·“Ó¦Ģį¹©×ćĮæµÄ£ŗCO2 £¬ ¹Ź“š°øĪŖ£ŗCO2£»
£Ø2.£©¢Ł¼ÓČėŃĪĖį£¬µŚŅ»½×¶Ī·“Ó¦±¾ÖŹĪŖ£ŗOH©+H+=H2O”¢CO32©+H+=HCO3©£»Éś³ÉĘųĢåµÄ·“Ó¦±¾ÖŹĪŖ£ŗHCO3©+H+=CO2”ü+H2O£¬Éś³É¶žŃõ»ÆĢ¼ĻūŗÄŃĪĖį£Ø90©85£©mL=5mL£¬Ōņn£ØCO32©£©=n£ØHCO3©£©=0.005L”Į2mol/L=0.01mol£¬¹Źn£ØOH©£©=0.085L”Į2mol/L©0.01mol=0.16mol£¬¹ŹŌņ¼īŹ½Ģ¼ĖįĀĮĆ¾ÖŠn£ØOH©£©£ŗn£ØCO32©£©=0.16mol£ŗ0.01mol=16£ŗ1£¬¹Ź“š°øĪŖ£ŗ16£ŗ1£»¢Ś¼ÓČė¹żĮæµÄĒāŃõ»ÆÄĘČÜŅŗ£¬·“Ó¦ĶźČ«ŗó¾¹ż¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµĆ³Įµķ3.48gĪŖĒāŃõ»ÆĆ¾µÄÖŹĮ棬Ōņn[Mg£ØOH£©2]= ![]() =0.06mol£¬“ļĻ²ÖŠn£ØMg2+£©=n[Mg£ØOH£©2]=0.06mol£¬
=0.06mol£¬“ļĻ²ÖŠn£ØMg2+£©=n[Mg£ØOH£©2]=0.06mol£¬
ĄūÓƵēŗÉŹŲŗć2n£ØMg2+£©+3n£ØAl3+£©=n£ØOH©£©+2n£ØCO32©£©£¬¹Ź3n£ØAl3+£©=0.16mol+0.01mol”Į2©0.06mol”Į2=0.06mol£¬¹Źn£ØAl3+£©=0.02mol£¬
¹Ź£ŗm£ØCO32©£©=0.01 mol”Į60 gmol©1=0.6 g
m£ØOH©£©=0.16 mol”Į17 gmol©1=2.72 g
m£ØMg2+£©=0.06 mol”Į24 gmol©1=1.44 g
m£ØAl3+£©=0.02 mol”Į27 gmol©1=0.54 gĖłŅŌ£¬m£ØH2O£©=6.02g©0.6g©2.72g©1.44g©0.54g=0.72g£¬¹Źn£ØH2O£©= ![]() =0.04 molŌņn£ØMg2+£©£ŗn£ØAl3+£©£ŗn£ØOH©£©£ŗn£ØCO32©£©£ŗn£ØH2O£©=0.02£ŗ0.06£ŗ0.16£ŗ0.01£ŗ0.04=6£ŗ2£ŗ16£ŗ1£ŗ4£¬“ļĻ²µÄ×é³ÉĪŖMg6Al2£ØOH£©16CO34H2O£¬¹Ź“š°øĪŖ£ŗMg6Al2£ØOH£©16CO34H2O£®
=0.04 molŌņn£ØMg2+£©£ŗn£ØAl3+£©£ŗn£ØOH©£©£ŗn£ØCO32©£©£ŗn£ØH2O£©=0.02£ŗ0.06£ŗ0.16£ŗ0.01£ŗ0.04=6£ŗ2£ŗ16£ŗ1£ŗ4£¬“ļĻ²µÄ×é³ÉĪŖMg6Al2£ØOH£©16CO34H2O£¬¹Ź“š°øĪŖ£ŗMg6Al2£ØOH£©16CO34H2O£®
£Ø1.£©Ć÷·ÆŹÆŗ¬ÓŠAl2O3ŗĶFe2O3µČŌÓÖŹ£¬¼Ó×ćĮæµÄĻ”°±Ė®£¬Ć÷·ÆŹÆÖŠµÄĀĮĄė×ÓÓė°±Ė®·“Ó¦£¬¹żĀĖŗó³ĮµķIÖŠŗ¬Al2O3”¢Fe2O3”¢Al£ØOH£©3 £¬ ČÜŅŗIÖŠŗ¬¼ŲĄė×Ó”¢ļ§øłĄė×Ó”¢ĮņĖįøłĄė×Ó£¬ĀĖŅŗ¾¹żÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖµĆµ½ĮņĖį¼Ų”¢ĮņĖįļ§¾§Ģ壮Al2O3”¢Fe2O3”¢Al£ØOH£©3ÖŠ¼ÓČėĒāŃõ»ÆÄĘ£¬Fe2O3ÓėĒāŃõ»ÆÄĘ²»·“Ó¦£¬Al2O3”¢ĒāŃõ»ÆĀĮÓėĒāŃõ»ÆÄĘ·“Ó¦£ŗAl£ØOH£©3+NaOHØTNaAlO2+2H2O£¬Al2O3+2NaOHØT2NaAlO2+H2O£¬ĀĖŅŗÖŠŗ¬ÓŠNaAlO2ČÜŅŗ£¬³Įµķ¢ņĪŖŃõ»ÆĢś£¬ĀĖŅŗÖŠĶØČė×ćĮæµÄæÕĘų£¬·¢Éś·“Ó¦£ŗNaAlO2+CO2+2H2O=Al£ØOH£©3”ż+NaHCO3 £¬ ŌŁ¹żĀĖµĆµ½ĒāŃõ»ÆĀĮ£¬ČÜŅŗ¢óÖŠŗ¬ÓŠNaHCO3 £®
£Ø2.£©¢Ł¼ÓČėŃĪĖį£¬µŚŅ»½×¶Ī·“Ó¦±¾ÖŹĪŖ£ŗOH©+H+=H2O”¢CO32©+H+=HCO3©£»Éś³ÉĘųĢåµÄ·“Ó¦±¾ÖŹĪŖ£ŗHCO3©+H+=CO2”ü+H2O£¬½įŗĻĻūŗÄŃĪĖį¼ĘĖćn£ØOH©£©”¢n£ØCO32©£©£»¢Ś¼ÓČė¹żĮæµÄĒāŃõ»ÆÄĘČÜŅŗ£¬·“Ó¦ĶźČ«ŗó¾¹ż¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµĆ³Įµķ3.48gĪŖĒāŃõ»ÆĆ¾µÄÖŹĮ棬øł¾Żn= ![]() ¼ĘĖćn[Mg£ØOH£©2]£¬“ļĻ²ÖŠn£ØMg2+£©=n[Mg£ØOH£©2]£¬ĄūÓƵēŗÉŹŲŗć2n£ØMg2+£©+3n£ØAl3+£©=n£ØOH©£©+2n£ØCO32©£©¼ĘĖćn£ØAl3+£©£¬øł¾Ż½įŗĻѳʷ֏ĮæĒóµĆĖ®µÄÖŹĮ棬ŌŁøł¾Żøł¾Żn=
¼ĘĖćn[Mg£ØOH£©2]£¬“ļĻ²ÖŠn£ØMg2+£©=n[Mg£ØOH£©2]£¬ĄūÓƵēŗÉŹŲŗć2n£ØMg2+£©+3n£ØAl3+£©=n£ØOH©£©+2n£ØCO32©£©¼ĘĖćn£ØAl3+£©£¬øł¾Ż½įŗĻѳʷ֏ĮæĒóµĆĖ®µÄÖŹĮ棬ŌŁøł¾Żøł¾Żn= ![]() ¼ĘĖćn£ØH2O£©£¬¾Ż“ĖČ·¶Øn£ØMg2£©£ŗn£ØAl3+£©£ŗn£ØOH©£©£ŗn£ØCO32©£©£ŗn£ØH2O£©£¬¾Ż“ĖŹéŠ“»ÆѧŹ½£®
¼ĘĖćn£ØH2O£©£¬¾Ż“ĖČ·¶Øn£ØMg2£©£ŗn£ØAl3+£©£ŗn£ØOH©£©£ŗn£ØCO32©£©£ŗn£ØH2O£©£¬¾Ż“ĖŹéŠ“»ÆѧŹ½£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ2A£«B=3C£«4D·“Ó¦ÖŠ£¬±ķŹ¾øĆ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ£Ø””””£©
A.v£ØA£©£½0.5 mol”¤L£1”¤s£1B.v£ØB£©£½0.3 mol”¤L£1”¤s£1
C.v£ØC£©£½0.8 mol”¤L£1”¤s£1D.v£ØD£©£½1 mol”¤L£1”¤s£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ×ŌČ»½ēÖŠĀČ»ÆÄĘŹĒÓÉ![]() Óė
Óė![]() ŗĶ
ŗĶ![]() Ėł¹¹³ÉµÄ”£ŅŃÖŖĀČŌŖĖŲµÄĻą¶ŌŌ×ÓÖŹĮæŹĒ35.5£¬Ōņ11.7gĀČ»ÆÄĘÖŠ£¬ŗ¬
Ėł¹¹³ÉµÄ”£ŅŃÖŖĀČŌŖĖŲµÄĻą¶ŌŌ×ÓÖŹĮæŹĒ35.5£¬Ōņ11.7gĀČ»ÆÄĘÖŠ£¬ŗ¬![]() µÄÖŹĮæĪŖ(””””)
µÄÖŹĮæĪŖ(””””)
A. 1.75g B. 1.85g C. 5.25g D. 5.55g
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ŹĒCu©ZnŌµē³ŲµÄ×°ÖĆŹ¾ŅāĶ¼£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £© 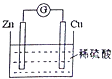
A.ZnʬŹĒÕż¼«
B.µē³Ų¹¤×÷Ź±£¬H+ŌŚĶʬÉĻµĆµē×Ó
C.µē³Ų¹¤×÷Ź±£¬µēÄÜ×Ŗ±äĪŖ»ÆѧÄÜ£¬ĒŅŠæʬ֚½„±»ĻūŗÄ
D.µē³Ų¹¤×÷Ź±£¬µē×Ó“ÓŠæʬĶعżĮņĖįČÜŅŗĮ÷ĻņĶʬ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĻĀ±ķÖŠµÄŠÅĻ¢·ÖĪö»Ų“šĪŹĢā£ŗ
ŌŖĖŲ | ŌŖĖŲ»ņÓÉŌŖĖŲ×é³ÉµÄĪļÖŹŠŌÖŹ |
A | µ„ÖŹŌŚ×ŌČ»½ēÖŠÓ²¶Č×ī“ó£¬Č¼ÉÕ²śÉśµÄĘųĢåÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē”£ |
B | Ō×Ó×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżČż±¶ |
C | ½šŹōŃęÉ«·“Ó¦ĪŖ»ĘÉ«£¬ÓėŃõĘųČ¼ÉÕÉś³Éµ»ĘÉ«¹ĢĢå |
D | µ„ÖŹŌŚæÕĘųÖŠĢå»ż·ÖŹż×ī“ó |
E | ¹ĢĢåĪŖµ»ĘÉ«£¬Č¼ÉÕ²śÉśĘųĢåÓŠĘư׊Ō”£ |
F | ĻąĶ¬Ģõ¼žĻĀĘųĢåĆܶČ×īŠ” |
£Ø1£©ÓƵē×ÓŹ½Š“³öŠĪ³ÉF2EµÄ¹ż³Ģ__________________£»
£Ø2£©Š“³öCBFĪļÖŹµÄµē×ÓŹ½______________£»
£Ø3£©C2B2ĪļÖŹÖŠ“ęŌŚ»Æѧ¼üµÄĄąŠĶŹĒ___________ £¬1 molC2B2Óė×ćĮæAB2·“Ó¦×ŖŅʵĵē×ÓŹżĪŖ_______£»
£Ø4£©ÓÉB”¢C”¢EŠĪ³ÉµÄ¼ņµ„Ąė×Ó°ė¾¶Óɓ󵽊”µÄ¹ŲĻµŹĒ______________£ØÓĆĄė×Ó·ūŗűķŹ¾£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢EŗĶF±ķŹ¾ŗ¬ÓŠ10øöµē×ÓµÄĪ¢Į££¬Ēė»Ų“š£ŗ
£Ø1£©AĄė×ÓĪŖµ„ŗĖĄė×ÓĒŅAŌ×ÓŌŚĖłŌŚÖÜĘŚÖŠŌ×Ó°ė¾¶×ī“ó£¬AĄė×ÓŹĒ______£»£ØĢīĄė×Ó·ūŗÅ£©
£Ø2£©DŹĒÓÉĮ½ÖÖŌŖĖŲ×é³ÉµÄ·Ö×Ó£¬ĘäĖ®ČÜŅŗ³Ź¼īŠŌ£¬DµÄ½į¹¹Ź½ŹĒ_______________£»
£Ø3£©Ļņŗ¬BĪ¢Į£ČÜŅŗÖŠ¼ÓČėŗ¬FĪ¢Į£ČÜŅŗ£¬ĻČ³öĻÖ°×É«³Įµķ£¬¼ĢŠų¼ÓČėŗ¬FĪ¢Į£ČÜŅŗ³ĮµķČܽā£¬Š“³öøĆ¹ż³ĢµÄĄė×Ó·½³ĢŹ½__________________________________
£Ø4£©Ļņŗ¬EĪ¢Į£ČÜŅŗÖŠ¼ÓČėŗ¬FĪ¢Į£ČÜŅŗ£¬²¢¼ÓČČÉś³É CŗĶD£¬Š“³öøĆĄė×Ó·½³ĢŹ½____________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ±½µÄŠšŹöÕżČ·µÄŹĒ

A. ·“Ó¦¢ŁĪŖČ”“ś·“Ó¦£¬ÓŠ»ś²śĪļÓėĖ®»ģŗĻø”ŌŚÉĻ²ć
B. ·“Ó¦¢ŚĪŖŃõ»Æ·“Ó¦£¬·“Ó¦ĻÖĻóŹĒ»šŃęĆ÷ĮĮ²¢“ųÓŠÅØŃĢ
C. ·“Ó¦¢ŪĪŖČ”“ś·“Ó¦£¬ÓŠ»ś²śĪļŹĒŅ»ÖÖĢž
D. ·“Ó¦¢ÜÖŠ1 mol±½×ī¶ąÓė3 mol H2·¢Éś¼Ó³É·“Ó¦£¬ŅņĪŖĆæøö±½·Ö×Óŗ¬ÓŠČżøöĢ¼Ģ¼Ė«¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČē±ķĖłĮŠø÷×éĪļÖŹÖŠ£¬ĪļÖŹÖ®¼äĶعżŅ»²½·“Ó¦ÄÜŹµĻÖČēĶ¼ĖłŹ¾×Ŗ»ÆµÄŹĒ£Ø £©
X | Y | Z | |
¢Ł | Cu | CuO | Cu£ØOH£©2 |
¢Ś | CH3CH2OH | CH3CHO | CH2ØTCH2 |
¢Ū | Na2CO3 | NaOH | NaHCO3 |
¢Ü | CaCO3 | CaO | Ca£ØOH£©2 |
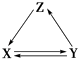
A.¢Ś¢Ū
B.¢Ū¢Ü
C.¢Ś¢Ü
D.¢Ł¢Ś
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com