
| A. | 碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液 | |
| B. | 碱式滴定管尖端有气泡,滴定后气泡消失 | |
| C. | 记录消耗的碱液,滴定前平视,滴定后俯视凹液面 | |
| D. | 锥形瓶用蒸馏水洗净后,直接装入未知浓度的盐酸 |
分析 中和滴定时,c(酸)V(酸)=c(碱)V(碱),则c(酸)=$\frac{c(碱)V(碱)}{V(酸)}$,若V(碱)偏小或V(酸)偏大时盐酸物质的量浓度偏低,以此来解答.
解答 解:A.碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液,消耗V(碱)偏大,则盐酸的浓度偏大,故A不选;
B.碱式滴定管尖端有气泡,滴定后气泡消失,消耗V(碱)偏大,则盐酸的浓度偏大,故B不选;
C.记录消耗的碱液,滴定前平视,滴定后俯视凹液面,消耗V(碱)偏小,则盐酸的浓度偏小,故C选;
D.锥形瓶用蒸馏水洗净后,直接装入未知浓度的盐酸,盐酸的物质的量不变,消耗V不变,对实验无影响,故D不选;
故选C.
点评 本题考查中和滴定实验,为高频考点,把握滴定原理、操作及误差分析为解答的关键,侧重分析与应用能力的考查,注意结合公式分析误差,题目难度不大.


科目:高中化学 来源: 题型:选择题
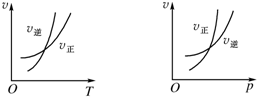 可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )| A. | m<n+p,Q>0 | B. | m>n+p,Q>0 | C. | m<n+p,Q<0 | D. | m>n+p,Q<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 反应初始至平衡,A的平均反应速率v(A)=0.005 mol•L-1•s-1 | |
| B. | 增大压强,正、逆反应速率均加快 | |
| C. | 该反应正向为吸热反应,升高温度,K值增大,平衡正向移动 | |
| D. | 达到平衡后,B的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
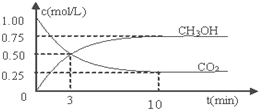
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{17}O$原子核内含有8个中子 | B. | ${\;}_{8}^{17}O$原子核内含有8个质子 | ||
| C. | ${\;}_{8}^{17}O$原子核外有17个电子 | D. | ${\;}_{8}^{17}O$原子核内含有17个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
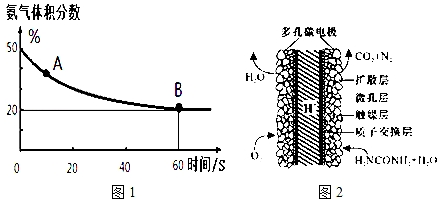
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
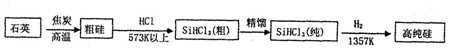
| N2H4 | N2O4 | |
| 密度/g/cm3 | 1.004 | 1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子直径在1~100nm之间 | B. | 胶体粒子带电荷 | ||
| C. | 胶体粒子能穿过滤纸 | D. | 胶体粒子能够发生布朗运动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com