
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是
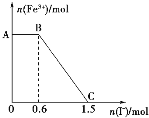
A. 图中AB段的氧化剂为K2Cr2O7
B. 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C. 若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则AB段有蓝色沉淀生成
D. 开始加入的K2Cr2O7为0.25 mol
【答案】C
【解析】
A.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB段应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,A正确;
B.BC段Fe3+浓度逐渐减小,为Fe3+和KI电离产生的I-之间的反应,反应的离子方程式为2Fe3++2I-=2Fe2++I2,B正确;
C.将KI溶液换为K3[Fe(CN)6]溶液,由于过程中没有Fe2+出现所以没有蓝色沉淀生成,C错误;
D.由氧化剂和还原剂得失电子数目相等可知反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为n(K2Cr2O7)=![]() =0.25mol,D正确;
=0.25mol,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
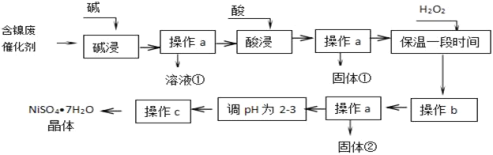
【题目】镍是有机合成的重要催化剂。某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
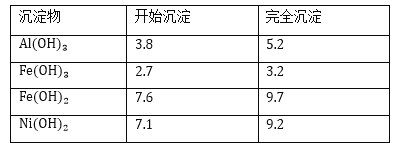
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含金属元素的离子是_________;
(2)用离子方程式表示加入双氧水的目的______________;双氧水可以用下列物质替代的是_________
A.氧气 ![]() 漂白液
漂白液 ![]() 氯气
氯气 ![]() 硝酸;
硝酸;
(3)操作b调节溶液pH范围为______________;
(4)操作a和c需要共同的玻璃仪器是_______;上述流程中,防止浓缩结晶过程中,Ni2+水解的措施是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式是A+B![]() X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
(1)若Y是黄绿色气体,则Y的电子式是______,该反应的离子方程式是______。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是________.
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①元素在周期表中的位置是______(填所在周期和族);Y的化学式是______。
②含amolX的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______mol。
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E 都含X元素,其转化关系如下图所示。

(1)请分别写出A、B、C、D、E的化学式(如为溶液请填溶质的化学式):
A _____,B _____,C ______,D_____,E___________。
(2)写出下列反应的化学方程式:
A+H2O:______________;
A+NaOH:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.
(1)A的结构简式为_______________________。
(2)A中肯定共面的碳原子数有__个。
(3)若0.1 mol的烃A完全燃烧后,燃烧时消耗标准状况下的氧气____L。
(4)A在催化剂加热条件下发生加聚反应,化学方程式为_______________________________。
(5)在催化剂作用下,与H2加成后的产物名称为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于焓变(ΔH)的叙述或判断中错误的是

A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的 ΔH<0
B. 500 ℃、30 MPa下,0.5 mol N2和1.5 mol H2充分反应放出 19.3 kJ 热量,则反应“N2(g)+3H2(g) ![]() 2NH3(g)”的 ΔH=-38.6 kJ·mol-1
2NH3(g)”的 ΔH=-38.6 kJ·mol-1
C. 据下图1 知:ΔH1 = ΔH2+ΔH3
D. 据下图2 知:E的大小对该反应的ΔH 无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A. 以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. 其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C. 其他条件不变,若增大压强,则物质A的转化率减小
D. 达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有Mg2+、Ba2+ 、Ag+和NO3-,现分别用NaCl溶液、NaOH溶液和Na2CO3溶液将溶液中三种阳离子逐一完全沉淀分离,其流程如右图所示。下列说法正确的是( )

A. 试剂A可能为NaOH溶液
B. 沉淀2只能是BaCO3 ,不可能是Mg(OH)2
C. 每加一种试剂需过量但不需要过滤即可进行下一步
D. 生成沉淀1的离子方程式只能是:Ag+ + Cl- = AgCl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色溶液。
I.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。(1)写出与H2O分子互为等电子体的微粒:_________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+ )。下列对上述过程的描述不合理的是____(填字母序号)。
A.氧原子的杂化类型发生了改变 B.微粒子的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
II. Cu2+可形成多种配合物,广泛应用于生产生活中。
(3) 实验时将白色粉末无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出该配离子的化学式 :______。向该蓝色溶液中滴加氨水,先形成难溶物,继续加氨水,难溶物溶解,写出溶解过程的离子方程式:________。溶解后得到深蓝色溶液,向溶液加入乙醇,会析出深蓝色晶体,该晶体的化学式为_________ 。
(4)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图)

①H、O、N三种元素的电负性从大到小的顺序_______________________.
②乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是_________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com