
(22分)
(Ⅰ)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
⑴丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC
CH4(g)+HC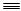 CH(g)+H2(g)
CH(g)+H2(g)  kJ/mol
kJ/mol
CH3CH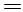 CH2(g)
CH2(g) CH4(g)+HC
CH4(g)+HC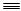 CH(g)
CH(g) 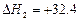 kJ/mol
kJ/mol
则相同条件下,反应C3H8(g) CH3CH
CH3CH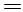 CH2(g)+H2(g)的
CH2(g)+H2(g)的 kJ/mol。
kJ/mol。
⑵以丙烷为燃料制作新型燃料电池,电池的一极通入O2和CO2,另一极通入丙烷,电解质是熔融碳酸盐。通丙烷的一极是电池的 极,电池负极的电极反应式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
(Ⅱ)如下图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和物质的量浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。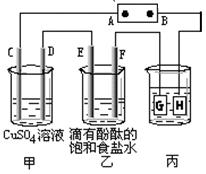
⑴A极是电源的 极。
⑵若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
⑶现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。
当乙中溶液的c(OH-)=0.1mol/L(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的c(H+) (填“变大”、“变小”或“不变”)。
⑷上图甲装置电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,
恰好使溶液恢复到电解前的浓度。则乙装置中,若不考虑Cl2的溶解及与碱的反应,此装置共产生气体 L(标准状况)。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1= CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-, CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com