

| A. | 篮烷的分子式为C12H14 | |
| B. | 篮烷分子中存在2个六元环 | |
| C. | 篮烷分子中存在2个五元环 | |
| D. | 篮烷的一氯代物共有4种同分异构体 |
分析 A、交点为C原子,交点之间的短线是化学键,利用H原子饱和碳的四价结构,据此书写分子式;
B、交点为C原子,根据分子结构中环中含有的碳原子数目,进行判断;
C、交点为C原子,根据分子结构中环中含有的碳原子数目,进行判断;
D、该分子属于高度对称结构,根据对称性判断分子中等效H原子数目,有几种H原子,其一氯代物就有几种异构体.
解答 解:A、由蓝烷的结构可知,分子中含有12个C原子、14个H原子,分子式为C12H14,故A正确;
B、由蓝烷的结构可知,有如图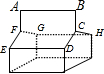 所示的ABCDEF、ABCHGF、CDEFGH3个六元环,故B错误;
所示的ABCDEF、ABCHGF、CDEFGH3个六元环,故B错误;
C、由蓝烷的结构可知,有如图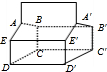 所示的ABCDE、与A′B′C′D′E′2个五元环,故C正确;
所示的ABCDE、与A′B′C′D′E′2个五元环,故C正确;
D、该分子属于高度对称结构,有如图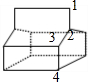 所示的4种H原子,故其一氯代物有4种同分异构体,故D正确;
所示的4种H原子,故其一氯代物有4种同分异构体,故D正确;
故选B.
点评 本题考查有机物的结构、同分异构体等,题目难度中等,实际是键线式结构,注意对结构的仔细观察.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定含有KNO3,没有Ba(NO3)2;可能含有Na2CO3 | |
| B. | 肯定含有Na2CO3,没有Ba(NO3)2 | |
| C. | 肯定没有Na2CO3,Ba(NO3)2 | |
| D. | 无法判断含何种杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +2(x+y+z)Li$?_{Charge}^{Dlsctarge}$
+2(x+y+z)Li$?_{Charge}^{Dlsctarge}$ +(x+y+z)Li2S
+(x+y+z)Li2S| A. | 该电池的电解质溶液为Li2S溶液 | |
| B. | 放电时,电子由负极经固体电解质到正极;Li+由负极经外电路到正极 | |
| C. | 放电时的正极反应式为: +2(x+y+z)Li++2(x+y+z)e-= +2(x+y+z)Li++2(x+y+z)e-= +(x+y+z)Li2S +(x+y+z)Li2S | |
| D. | 充电时,原电池的正极与电源负极相连;原电池负极与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①是加成反应,②是还原反应 | |
| B. | W存在顺反异构,另一种结构为 | |
| C. | X的官能团由烯键和酯基 | |
| D. | 按照系统命名法, 为乙烯基丙酸乙酯 为乙烯基丙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol/(L•s) | B. | v(B)=0.3mol/(L•s) | C. | v(c)=0.8 mol/(L•s) | D. | v(D)=30mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com