
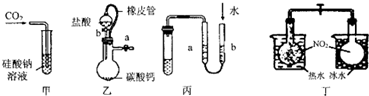
| A. | 甲装置:可用来证明碳的非金属性比硅强 | |
| B. | 乙装置:橡皮管的作用是保证装置不漏气 | |
| C. | 丙装置:用图示的方法检查此装置的气密性 | |
| D. | 丁装置:探究温度对平衡的影响 |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.橡皮管的作用是能让分液漏斗和蒸馏烧瓶间压强平衡;
C.检查装置的气密性原理是根据装置内外的压强差形成水柱或气泡;
D.升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热反应方向移动.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,二氧化碳和水反应是生成碳酸,碳酸和硅酸钠反应生成难溶性硅酸,所以能实现实验目的,故A正确;
B.橡皮管的作用是能让分液漏斗和蒸馏烧瓶间压强平衡,使分液漏斗中的液体顺利流下,故B错误;
C.检查装置的气密性原理是根据装置内外的压强差形成水柱或气泡,所以可以检验装置气密性,故C正确;
D.2NO2?N2O4△H<0,根据颜色的变化可知平衡移动的方向,以此可确定温度对平衡移动的影响,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及元素性质判断、基本实验操作、化学反应原理等知识点,明确实验原理及基本操作方法是解本题关键,易错选项是B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
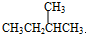 与
与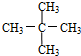 G.
G.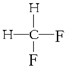 与
与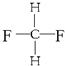
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
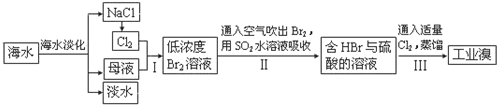
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.0020mol/(L•s) | B. | v(O2)=0.0026mol/(L•s) | ||
| C. | v(NO)=0.0020mol/(L•s) | D. | v(H2O)=0.0028mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 油脂和汽油都属于酯类,都能用作工业制肥皂 | |
| C. | 纯碱可用于生成普通玻璃,日常生活中也可能用初年溶液来除去物品表面的油污 | |
| D. | 雾霾严重影响了人们的正常生活,为改善空气质量,可以加高工厂的烟囱,使灰尘和废气远离地表 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述电解过程中铜转移2mol电子 | B. | 电解后溶液中c(H+)为4mol/L | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 原混合溶液中c(K+)为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
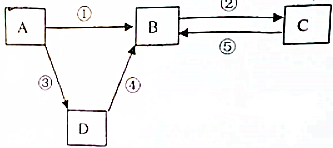
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | SO2具有氧化性,可用于漂白纸浆 | |
| C. | 氯化铝是一种电解质,可用于电解法制铝 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
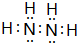 ,Z由两个相同基团构成,该基团的名称是羟基.
,Z由两个相同基团构成,该基团的名称是羟基.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com