
| A. | agC2H4和C3H6的混合物所含原子总数为$\frac{3a{N}_{A}}{14}$ | |
| B. | 1.00mol/LNaCl溶液100mL,含有6.02×1022个NaCl分子 | |
| C. | 300mL2mol/L蔗糖溶液中所含分子数大于0.6NA | |
| D. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA |
分析 A、C2H4和C3H6的最简式均为CH2;
B、氯化钠为离子晶体;
C、蔗糖溶液中,除了蔗糖分子还有水分子;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、C2H4和C3H6的最简式均为CH2,故ag混合物中含有的CH2的物质的量为n=$\frac{ag}{14g/mol}$=$\frac{a}{14}mol$,故含有的原子总数为$\frac{3a{N}_{A}}{14}$个,故A正确;
B、氯化钠为离子晶体,溶于水后完全电离,故溶液中无氯化钠分子,故B错误;
C、蔗糖溶液中,除了蔗糖分子还有水分子,故溶液中的分子个数大于0.6NA个,故C正确;
D、常温常压下,气体摩尔体积大于22.4L/mol,故2.24L混合气体的物质的量小于0.1mol,则含有的氧原子数小于0.2NA个,故D错误.
故选AC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| B. | 室温下,31g白磷分子中含有共价键数目为4NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| D. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸滴在石灰石上:CO32-+2H+═H2O+CO2↑ | |
| B. | 少量CO2通入氢氧化钠溶液中:2OH-+CO2═CO32-+H2O | |
| C. | NaOH溶液和NaHSO4溶液反应:HSO4-+OH-═SO42+H2O | |
| D. | 稀H2SO4滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 实验室用NH4Cl和Ca(OH)2制备NH3涉及氧化还原反应 | |
| D. | 将分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
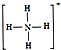 ,白磷(P4)的结构式为
,白磷(P4)的结构式为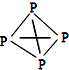 ,请画出N4H44+的结构式
,请画出N4H44+的结构式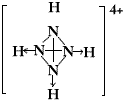 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g甲烷(12CH4)所含的中子数为5NA | |
| B. | 64g的铜发生氧化还原反应,一定失去2NA个电子 | |
| C. | 常温常压下,0.5 mol•L-1的乙酸溶液中,乙酸的分子数目略小于0.05NA | |
| D. | 标准状况下,22.4L 氧单质中氧原子数可能为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入1mol N2和3mol H2,充分反应生成NH3分子数为2NA | |
| B. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| C. | 30g SiO2中含有的Si-O键数目为2NA | |
| D. | 标准状况下,4.48 L N2所含的共用电子对数0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、NO3-、MnO4- | B. | Na+、NO3?、SO42?、I? | ||
| C. | K +、Fe3+、Cl-、Br- | D. | Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com