
某元素X的原子的核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是( )。
A.X能形成化学式为X(OH)3的碱
B.X能与某些金属元素形成化合物
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X可能形成化学式为KXO3的盐
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2014年化学高考题型专练十六 基本理论综合应用题练习卷(解析版) 题型:填空题
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽车燃油、石油液化气、城市煤气等,市场前景极为广阔。它清洁、高效,具有优良的环保性能。
工业上制二甲醚是在一定温度(230~280 ℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应。
CO(g)+2H2(g) CH3OH(g) ΔH1=-90.7 kJ·mol-1 ①
CH3OH(g) ΔH1=-90.7 kJ·mol-1 ①
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 ②
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 ③
(1)反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),则该反应的ΔH=__________,平衡常数表达式为____________________,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会________(填升高、降低或不变)。
CH3OCH3(g)+CO2(g),则该反应的ΔH=__________,平衡常数表达式为____________________,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会________(填升高、降低或不变)。
(2)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)??CH3OCH3(g)+3H2O(g) ΔH>0。
该反应在恒温、体积恒定的密闭容器中进行,下列不能作为该反应已达到化学平衡状态的判断依据的是________。
A.容器内混合气体的密度不变
B.容器内混合气体的压强保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗2 mol CO2的同时消耗1 mol二甲醚
(3)二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚与乙醇互为同系物
D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
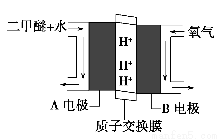
(4)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),写出A电极的电极反应式:________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十一 元素的单质及其化合物的性质与转化练习卷(解析版) 题型:选择题
下列转化关系中,不能通过一步反应实现的是 ( )。
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2 ⑤Na2O2→Na2SO4
A.①和② B.③和④ C.②③④ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练八 化学反应速率和化学平衡分析与判断练习卷(解析版) 题型:选择题
向一容积为1 L的密闭容器中加入一定量的X、Y,发生反应aX(g)+2Y(s) bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。

根据以上信息,下列说法正确的是 ( )。
A.用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol·L-1·min-1
B.根据上图可求得化学方程式中a∶b=1∶3
C.推测在第7 min时曲线变化的原因可能是升温
D.推测在第13 min时曲线变化的原因可能是降温
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练八 化学反应速率和化学平衡分析与判断练习卷(解析版) 题型:选择题
合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )。
CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )。
A.增加压强 B.降低温度 C.增大CO的浓度 D.更换催化剂
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练二 化学常用计量的理解和综合应用练习卷(解析版) 题型:选择题
阿伏加德罗常数的值可以用NA表示,下列说法中正确的是 ( )。
A.P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则1 mol该分子中含有的共价键数目是12NA
B.28 g氮气和4 g氦气所含的原子数目相等,均为NA个
C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA,小于0.2NA
D.Fe和水蒸气在加热条件下反应,生成1 mol H2,则转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练三 特定条件下离子方程式的书写与判断练习卷(解析版) 题型:选择题
下列离子方程式书写正确的是 ( )。
A.Fe3O4溶于足量稀HNO3:3Fe3O4+28H++NO3—=9Fe3++NO↑+14H2O
B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+=Ca2++CO2↑+H2O
C.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练一 化学与科学技术社会环境的关系练习卷(解析版) 题型:选择题
下列有关叙述不正确的是( )。
A.在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量
B.利用太阳能、潮汐能、风能发电,可以获取清洁能源
C.大量排放SO2、氮氧化物或CO2都会导致酸雨的形成
D.采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷(解析版) 题型:选择题
如图是模拟电化学反应装置图。下列说法正确的是( )

A.开关K置于N处,则铁电极的电极反应式为:Fe-2e-=Fe2+
B.开关K置于N处,可以减缓铁的腐蚀
C.开关K置于M处,则铁电极的电极反应式为: 2Cl--2e-=Cl2↑
D.开关K置于M处,电子从碳棒经开关K流向铁棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com