
| A. | 压强不再随时间而改变时 | |
| B. | 混合气体中各组成成分的含量不再改变时 | |
| C. | 气体的总质量不再改变时 | |
| D. | 单位时间内消耗1 mol I2,同时有2 mol HI生成时 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、两边化学计量数相等,压强始终不再随时间而改变,故A错误;
B、混合气体中各组成成分的含量不再改变时,说明各物质的量不变,反应达平衡状态,故B正确;
C、质量守恒可知,气体的总质量一直不改变,故C错误;
D、单位时间内消耗1 mol I2,同时有2 mol HI生成时,都体现的正反应方向,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
| 一氯乙酸 | K=1.4×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质都能在氧气中燃烧生成过氧化物 | |
| B. | N、O、F氢化物的稳定性依次减弱 | |
| C. | P、S、Cl最高正价依次升高 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都是无色、难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生取代反应 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 氟氯代烷(即氟利昂)是优良的制冷剂、灭火剂,需推广使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
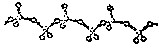 Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题:
Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题: ,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;
,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制备较弱酸 | 硫化氢通入硫酸铜溶液中不反应 |
| B | 压强越大,反应速率越快 | 加压,该反应2NH3?N2+3H2的正反应速率加快 |
| C | 金属性较强的金属为原电池的负极 | 铁、铜和浓硝酸形成的原电池,铁为负极 |
| D | 主族元素的最高正化合价等于主族的序数 | 氧的最高正化合价是+6 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com