
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为
A.直线形 sp杂化 
 B.三角形 sp2杂化
B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | H2S和NH3均是价电子总数为8的极性分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CH2Cl2和CCl4均是四面体构型的非极性分子 | |
| D. | SO2和SO3来化轨道类型均为sp2杂化,空间构型分别为V形、平面三角形 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
B.500℃、30MPa 下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·m
2NH3(g) △H=-38.6kJ·m ol-1
ol-1
C.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2 (g);△H=-283.0 kJ/mol
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:选择题
下列实验方案设计中,可行的是
A. 加稀盐酸后过滤,除出去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
D. 将O2和H2的混合物通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Y原子P能级上有2个未成对电子,Z原子比X原子的核外电子数多4。下列说法正确的是
A. X、Y、Z的电负性大小顺序是Z<Y<X
B. WY2分子中σ键与π键的数目之比是2∶1
C. W、X、Y、Z的原子半径大小顺序是X>Y>Z>W
D. W、Z形成的分子的空间构型是三角锥形
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
下列表达方式错误的是
A. D2O分子中氧原子为sp3杂化
B. Cr原子价电子排布式:3d54s1
C. 硫离子的核外电子排布式:1s22s22p63s23p6
D. S原子的电子排布图: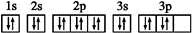
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:填空题
Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如 下图:
下图: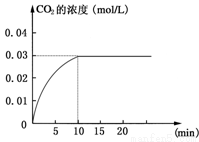
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(
为:___________,已知Ksp( AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
某金属能和盐酸反应生成氢气,与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 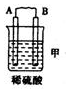 | 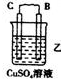 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com