
| A. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液:2HSO3-+4ClO-═2SO42-+2Cl-+2HClO | |
| D. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ |
分析 A.发生氧化还原反应,遵循电子、电荷守恒;
B.反应生成硅酸和亚硫酸氢钠;
C.物质的量比为3:2;
D.先氧化碘离子,再氧化亚铁离子.
解答 解:A.氢氧化铁溶于氢碘酸中的离子反应为2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O,故A正确;
B.向Na2SiO3溶液中通入过量SO2的 离子反应为SiO32-+2SO2+2H2O═H2SiO3↓+2HSO3-,故B错误;
C.向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液的离子反应为OH-+2HSO3-+3ClO-═2SO42-+2Cl-+HClO+H2O,故C错误;
D.向碘化亚铁溶液中滴加溴的四氯化碳溶液的离子反应为Br2+2I-═I2+2Br-,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及信息中量对反应的影响,题目难度不大.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
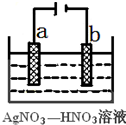 (1)由下列物质冶炼相应金属时采用电解法的是bd.
(1)由下列物质冶炼相应金属时采用电解法的是bd.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①②中的氧化剂分别是Sb2S3、Sb4O6 | |
| B. | 反应①中每生成3 mol FeS时,共转移6 mol电子 | |
| C. | 反应②说明高温下Sb的还原性比C强 | |
| D. | 每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | |||
| 丁 |
| A. | 原子半径:丙>丁 | |
| B. | 甲与丁的核外电子数相差10 | |
| C. | 氢氧化物碱性:丙>乙 | |
| D. | 甲、乙的最高价氧化物均是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
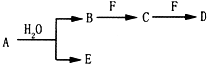 按要求回答下列问题:
按要求回答下列问题: ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com