
 重晶石(主要成分BaSO4)是制取可溶性钡盐的重要原料,工业上可用重晶石、焦炭、空气煅烧可制取BaS,其主要反应的热化学方程式如下:
重晶石(主要成分BaSO4)是制取可溶性钡盐的重要原料,工业上可用重晶石、焦炭、空气煅烧可制取BaS,其主要反应的热化学方程式如下: ,故答案为:
,故答案为: .
.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
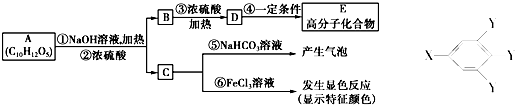
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 向500mL某碳酸钠溶液中逐滴加入1mol/L的盐酸,测得溶液中溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,则下列说法中正确的是 ( )
向500mL某碳酸钠溶液中逐滴加入1mol/L的盐酸,测得溶液中溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,则下列说法中正确的是 ( )| A、Oa段与ab段反应的离子方程式均为:CO32-+H+=HCO3- |
| B、该碳酸钠溶液的物质的量浓度为0.5mol/L |
| C、b点时,滴加盐酸的体积为600mL |
| D、b点时生成CO2的物质的量为0.3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 |
| B、反应①中,NaClO是氧化剂 |
| C、反应①为氧化还原反应,反应②为复分解反应 |
| D、若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于相对分子质量:HCl>HF,故沸点:HCl>HF |
| B、硅处于金属与非金属的过渡位置,硅可用作半导体材料 |
| C、由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 |
| D、Cl-、S2-、Ca2+、K+半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com