
分析 (1)根据N=nNA计算水分子数目,H原子数目为水分子的2倍,O原子数目等于水分子数目;
(2)铜离子物质的量等于氯化铜的物质的量,氯离子物质的量为氯化铜的2倍,根据N=nNA计算离子数目.
解答 解:(1)1mol H2O约含有水分子水分子数目为1mol×6.02×1023mol-1=6.02×1023,则含有H原子数目为:2×6.02×1023=1.204×1024,含有氧原子数目为6.02×1023,
故答案为:6.02×1023;1.204×1024;6.02×1023;
(2)0.5molCuCl2含有Cu2+离子数数目为0.5mol×6.02×1023mol-1=3.01×1023,含有Cl-离子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,
故答案为:3.01×1023;6.02×1023.
点评 本题考查物质的量有关计算,侧重考查微粒数目计算,注意对化学式意义的理解.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:选择题
 )与甲酸、乙酸、丙酸在一定条件下发生酯化反应,可得到的甘油三酯最多有(不考虑立体异构)( )
)与甲酸、乙酸、丙酸在一定条件下发生酯化反应,可得到的甘油三酯最多有(不考虑立体异构)( )| A. | 16种 | B. | 17种 | C. | 18种 | D. | 19种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
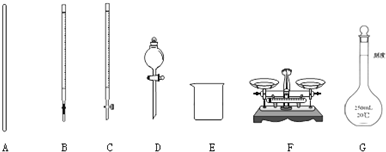
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2升的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数为4NA | |
| C. | 标准状况下,11.2升二氯甲烷所含分子数为0.5NA | |
| D. | 现有C2H4、C3H6、C4H8的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
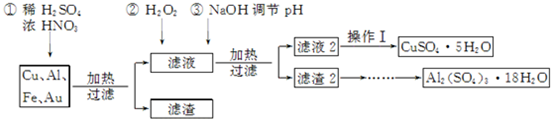
| 温度(K) | 失重(%) | |
| 第一阶段 | 323~523 | 40.54 |
| 第二阶段 | 553~687 | 48.65 |
| 第三阶段 | 1 043以上 | 84.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
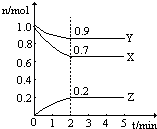 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
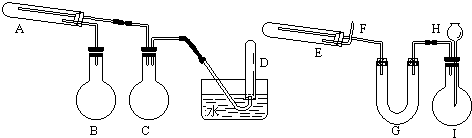
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中消耗铝的质量相同 | |
| B. | 反应中转移的电子数相同 | |
| C. | 反应中消耗的HCl与NaOH物质的量相同 | |
| D. | 溶液增加的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com