

| 放电 |
| 充电 |


科目:高中化学 来源: 题型:
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 | |||
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 起始浓度c/mol?dm3 | 平衡浓度c/mol?dm3 | K | 温度T | ||||
| H2 | N2 | NH3 | H2 | N2 | NH3 | |||
| 实验1 | 1.9868 | 1.356 | 0 | 1.35 | 1.15 | 0.412 | 5.98×10-2 | T1 |
| 实验2 | 0.6405 | 1.0435 | 0 | C1 | C2 | C3 | K2 | T1 |
| 实验3 | 0.6405 | 1.0435 | 0 | 0.51 | 1.00 | 0.087 | 6.05×10-2 | T2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 转变成
转变成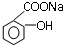 的方法是( )
的方法是( )| A、加入足量的NaOH(aq)并加热 |
| B、与足量NaOH(aq)共热后,通入足量CO2 |
| C、与盐酸共热后,加入足量的NaOH(aq) |
| D、与稀硫酸共热后,加入足量Na2CO3 (aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:

 (用反应流程图表示,无机试剂任选,并注明反应条件).
(用反应流程图表示,无机试剂任选,并注明反应条件).
| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com