
把100mL含有MgSO4和K2SO4的混合溶液分成二等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A. 20(2b﹣a) mol/L B. 20(b﹣2a) mol/L C. 10(2b﹣a) mol/L D. 10(b﹣2a) mol/L
考点: 有关混合物反应的计算.
分析: 两等份溶液中一份加NaOH溶液时发生Mg2++2OH﹣═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=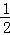 n(OH﹣),另一份加BaCl2的溶液发生Ba2++SO42﹣═BaSO4↓,由方程式可知n(SO42﹣)=n(Ba2+),再利用电荷守恒可知每份中:2n(Mg2+)+n(K+)=2n(SO42﹣),据此计算每份中n(K+),根据c=
n(OH﹣),另一份加BaCl2的溶液发生Ba2++SO42﹣═BaSO4↓,由方程式可知n(SO42﹣)=n(Ba2+),再利用电荷守恒可知每份中:2n(Mg2+)+n(K+)=2n(SO42﹣),据此计算每份中n(K+),根据c=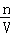 计算钾离子浓度.
计算钾离子浓度.
解答: 解:混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,
一份加加NaOH溶液时发生Mg2++2OH﹣═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)= n(OH﹣)=0.5amol,
n(OH﹣)=0.5amol,
另一份加BaCl2的溶液发生Ba2++SO42﹣═BaSO4↓,由方程式可知n(SO42﹣)=n(Ba2+)=n(BaCl2)=bmol,
由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42﹣),故每份中溶液n(K+)=2bmol﹣2×0.5amol=(2b﹣a)mol,故原溶液中钾离子浓度=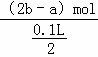 =20(2b﹣a) mol/L,
=20(2b﹣a) mol/L,
故选:A.
点评: 本题考查混合物有关计算,难度中等,根据电荷守恒计算钾离子的物质的量是关键.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
某小组用如图装置进行实验,下列说法正确的是
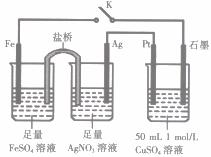
A.盐桥中的电解质可以用KC1
B.闭合K,外电路电流方向为Fe电极→石墨电极
C.闭合K,石墨电极上只生成铜
D.导线中流过0.15 mol e-时,加入5.55 gCu2(OH)2CO3 ,CuSO4溶液可恢复原组成
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于外界条件的改变对化学反应速率影响的说法中正确的是( )
|
| A. | 升高温度能加快吸热反应速率,减慢放热反应速率 |
|
| B. | 增大压强能加快气体体积缩小方向的反应速率,减慢气体体积增大方向的反应速率 |
|
| C. | 压强的改变只有通过浓度的改变才能影响化学反应速率 |
|
| D. | 若外界条件的改变引起了正、逆反应速率的改变,就一定能引起化学平衡的移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是( )
碱性氧化物 酸性氧化物 酸 碱 盐
A MgO Mn2O7 H3PO4 Ca(OH)2 KAl(SO4)2•12H2O
B Na2O NO2 HNO3 CH3OH NaCl
C Al2O3 SO3 HClO NaOH AgCl
D CaO SiO2 H2S Na2CO3 CH3COONa
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 只有活泼金属与活泼非金属元素原子之间才能形成离子键
B. Na2O2中阳离子和阴离子个数比为1:1
C. 形成离子键的阴、阳离子间只有静电吸引力
D. 共价键存在于共价化合物中,也可能存在于单质及离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是利用丙烯和对二甲苯合成有机高分子材料W的转化关系示意图.
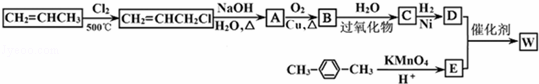
已知:①C不含甲基,B可以发生银镜反应,1molD与足量钠可生成22.4L H2(标准状况下).
①R﹣CH=CH2+H2O R﹣CH2CH2OH
R﹣CH2CH2OH
②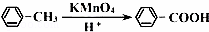
请完成下列各问:
(1)A的结构简式是 ,D的核磁共振氢谱图中有 个峰.
(2)C中所含官能团的名称 、 .
(3)C→D反应类型为 .
(4)有关物质B所具有的性质的叙述中正确的是(填序号) .
a.能发生银镜反应 b.能使溴水褪色 c.能发生酯化反应 d.可发生聚合反应
(5)写出下列反应的化学方程式:
①A→B: .
②D+E→W: .
③D的同分异构体(同一个碳原子上连接两个﹣OH的不能稳定存在)和E的同分异构体反应生成最小环酯: .
(6)物质E有多种同分异构体,请分别写出满足以下条件一个E的同分异构体的结构简式:
ⅰ.①遇FeCl3溶液显紫色 ②可发生银镜反应 ③能发生水解反应 .
ⅱ.①遇FeCl3溶液显紫色 ②可发生银镜反应 ③能和NaHCO3发生反应生成CO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A. 1:4 B. 1:5 C. 2:3 D. 2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
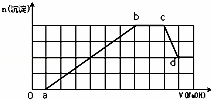
A. d点溶液中含有的溶质只有Na2SO4
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
C. ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
D. 原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com