
A、用稀硝酸洗涤试管内壁的银镜的离子方程式为:3Ag+4H++NO
| ||||||
B、浓硝酸中加入过量铁粉并加热:Fe+3NO
| ||||||
| C、过量的铜与浓硝酸反应有一氧化氮生成 | ||||||
| D、向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在试管口观察到红棕色气体 |
| ||


科目:高中化学 来源: 题型:
A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | ||||
| C、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6Cl- | ||||
| D、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取3.3mL蒸馏水 |
| B、用广泛pH试纸测得某溶液的pH为7.2 |
| C、用滴定管量取20.00mL NaOH溶液 |
| D、用电子天平称取2.100g NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两者颜色不一样 |
| B、两者外观上都不透明 |
| C、两者都能产生丁达尔现象 |
| D、两者不能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、蛋白质、油脂在一定条件下均能发生水解反应 |
| B、在油脂完全皂化后的混合物中加入热的饱和食盐水,搅拌,混合物上下分层,上层是固体肥皂 |
| C、在苯中加入溴水,充分震荡,所得液体显无色 |
| D、分子式是C2H4O2的有机物一定能与碳酸钠反应而放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4+Cl2
| |||
| B、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |||
C、
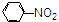 | |||
D、nCH2=CH2
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol?L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com