
| A. | -916.9 kJ/mol | B. | -458.45 kJ/mol | C. | +916.9 kJ/mol | D. | +458.45 kJ/mol |
分析 由①N2H4(l)+$\frac{1}{2}$N2O4(l)═$\frac{3}{2}$N2(g)+2H2O(l)△H=-546.45kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
结合盖斯定律可知①×2-②×4得到2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g),以此来解答.
解答 解:由①N2H4(l)+$\frac{1}{2}$N2O4(l)═$\frac{3}{2}$N2(g)+2H2O(l)△H=-546.45kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
结合盖斯定律可知①×2-②×4得到2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g),其△H=(-546.45kJ/mol)×2-(-44kJ/mol)×4=-916.9 kJ/mol,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意反应的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2.0 mol•L-1 | B. | 1.5 mol•L-1 | C. | 1 mol•L-1 | D. | 0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | CH3COOH | C. | (NH4)2 SO4 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
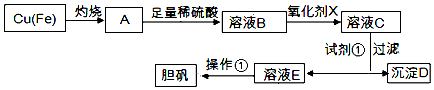
| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液、NaOH溶液、碱石灰 | B. | 浓氨水、NaOH固体、浓硫酸 | ||
| C. | NH4Cl固体、消石灰、碱石灰 | D. | 浓NaOH溶液、NH4C固体、浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①分离出BaSO4浊液中的BaSO4 | |
| B. | ②除去CO2中少量HCl气体 | |
| C. | ③配制一定物质的量浓度溶液时转移溶液 | |
| D. | ④制取一定量的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②⑤⑦ | C. | ②④⑦ | D. | ③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com