
(12分)亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组拟制备NaNO2并测定产品纯度。
I【查阅资料】
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性高锰酸钾氧化成NO2。
③酸性条件下MnO4-被还原为Mn2+。
Ⅱ【制备产品】
用如下装置制NaNO2(夹持和加热装置已省略)。
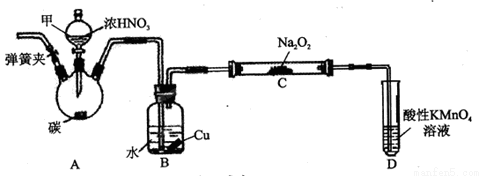
(1)装置A烧瓶中发生反应的化学方程式为_______________________。
(2)B装置的作用是_________________________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂可能是_________。(填字母编号)
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D.生石灰
Ⅲ【测定纯度】.
设计如下方案测定产品的纯度。

(4)溶液A到溶液B发生反应的离子方程式为____________________________。
(5)取样品2.3g经一系列操作后得到溶液A100mL,准确量取10.00mL A与24.00mL 0.05mol/L的酸性KMnO4溶液在锥形瓶中充分反应。反应后溶液用0.1 mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2 Fe(SO4)2溶液10.00ml,则样品中NaNO2的纯度为__________。
Ⅳ【探究反思】
(6)NaNO2的纯度偏低,该小组讨论提出的原因中可能正确的是________。(填字母编号)
A.滴定至溶液紫色刚好褪去就立刻停止滴加
B.加入A与KMnO4溶液前锥形瓶未经干燥
C.实验中使用的(NH4)2 Fe(SO4)2溶液暴露在空气中时间过长
(1)C+4HNO3(浓)  CO2↑+4NO2↑+2H2O;(2)将NO2转化为NO,同时铜与稀硝酸反应生成NO;(3)B、D;(4)2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;(5)75%;(6)C。
CO2↑+4NO2↑+2H2O;(2)将NO2转化为NO,同时铜与稀硝酸反应生成NO;(3)B、D;(4)2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;(5)75%;(6)C。
【解析】
试题分析:(1)在装置A烧瓶中浓硝酸与C在加热时发生氧化还原反应,化学方程式为C+4HNO3(浓)  CO2↑+4NO2↑+2H2O;(2)NO2溶于水,与水发生反应产生NO, 3NO2+ H2O == 2HNO3+ NO,产生的硝酸再与Cu发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。所以 B装置的作用是将NO2转化为NO,同时铜与稀硝酸反应生成NO;(3) CO2是酸性氧化物,可以与碱性发生反应,可以除去NO中的CO2气体的试剂是碱石灰、生石灰,故选项是B、D;(4)亚硝酸盐有还原性,高锰酸钾有强的氧化性,二者会发生反应,离子方程式为2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;(5)在氧化还原反应中电子转移数目相等,所以5n(MnO4-)=2n(NO2-)+n((NH4)2Fe(SO4)2)。所以在10.00mL的待测溶液中含有的NO2-的物质的量是: n(NO2-)=[5n(MnO4-)- n((NH4)2Fe(SO4)2)]÷2=[(5×0.024L ×0.05mol/L)+×0.01L×0.1 mol/L] ÷2=0.0025mol。所以样品中NaNO2的纯度为[(0.0025mol×69g/mol)÷(2.3g÷10)] ×100%=75%;(6) A.滴定至溶液紫色刚好褪去就立刻停止滴加,则V((NH4)2Fe(SO4)2)体积偏小,会使NaNO2的含量增大,错误;B.加入A与KMnO4溶液前锥形瓶未经干燥,对测定结果不产生任何影响,错误;C.实验中使用的(NH4)2 Fe(SO4)2溶液暴露在空气中时间过长,会被空气中的氧气氧化为Fe3+,则消耗的(NH4)2 Fe(SO4)2溶液的体积偏大,则会使NaNO2的含量偏小,错误。
CO2↑+4NO2↑+2H2O;(2)NO2溶于水,与水发生反应产生NO, 3NO2+ H2O == 2HNO3+ NO,产生的硝酸再与Cu发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。所以 B装置的作用是将NO2转化为NO,同时铜与稀硝酸反应生成NO;(3) CO2是酸性氧化物,可以与碱性发生反应,可以除去NO中的CO2气体的试剂是碱石灰、生石灰,故选项是B、D;(4)亚硝酸盐有还原性,高锰酸钾有强的氧化性,二者会发生反应,离子方程式为2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;(5)在氧化还原反应中电子转移数目相等,所以5n(MnO4-)=2n(NO2-)+n((NH4)2Fe(SO4)2)。所以在10.00mL的待测溶液中含有的NO2-的物质的量是: n(NO2-)=[5n(MnO4-)- n((NH4)2Fe(SO4)2)]÷2=[(5×0.024L ×0.05mol/L)+×0.01L×0.1 mol/L] ÷2=0.0025mol。所以样品中NaNO2的纯度为[(0.0025mol×69g/mol)÷(2.3g÷10)] ×100%=75%;(6) A.滴定至溶液紫色刚好褪去就立刻停止滴加,则V((NH4)2Fe(SO4)2)体积偏小,会使NaNO2的含量增大,错误;B.加入A与KMnO4溶液前锥形瓶未经干燥,对测定结果不产生任何影响,错误;C.实验中使用的(NH4)2 Fe(SO4)2溶液暴露在空气中时间过长,会被空气中的氧气氧化为Fe3+,则消耗的(NH4)2 Fe(SO4)2溶液的体积偏大,则会使NaNO2的含量偏小,错误。
考点:考查氧化还原反应方程式的书写、物质的作用、氧化还原反应中物质纯度的计算的知识。


科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
某有机化合物的结构简式如下:
 。
。
此有机化合物属于
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥芳香族化合物
A.①②③④⑥ B.②④⑥ C.②④⑤⑥ D.①③⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.碳酸氢钙溶液和过量氢氧化钙溶液混合:Ca2++2HCO3-+OH-=CaCO3↓+CO32-+H2O
B.CuCl2溶液与Na2S溶液2:1反应,Cu2++ S2-= CuS↓
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO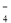 + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中一定能大量共存的是
A.pH=13的溶液中:AlO2-、CO32-、NO3-、Na+
B.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
C.含大量Al3+的溶液中:K+、NH4+、NO3-、HCO3-
D.在由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Ba2+、CO32-、ClO-、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从小到大的是
A.p (Ne) < p (H2) < p (O2) B.p (H2) < p (O2) < p (Ne)
C.p (O2) < p (Ne) < p (H2) D.p (H2) < p (Ne) < p (O2)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
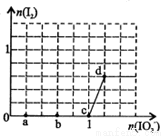
A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.1.7 g羟基所含电子的数目为NA
B.0.1 mol丙烯醛中含有双键的数目为0.1NA。
C.室温时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA
D.标准状况下,7.8 g苯中含氢原子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
五种短周期元素在周期表中的位置如图所示,其中Z元素原子的最外层电子数等于电子层数。下列判断正确的是
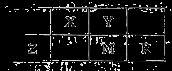
A.Z的氧化物可以做光导纤维
B.气态氢化物稳定性:M>R
C.最高价氧化物对应水化物的酸性:Y>X
D.Z、M、R的原子半径依次增大,最高化合价依次升高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
下列物质与其用途完全符合的有几条
①Na2CO3-制玻璃 ②SiO2-太阳能电池 ③AgI-人工降雨
④NaCl-制纯碱 ⑤Al2O3-焊接钢轨 ⑥NaClO-消毒剂
⑦MgO-耐火材料 ⑧Fe2O3-红色油漆或涂料
A、4 B、5 C、6 D、7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com