
����Ŀ����ԭ���������������ֶ�����Ԫ��(����ĸx��ʾ)ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯����ͼ��ʾ��

�����жϻش���������:
��1��f�����ڱ��е�λ����__________��
��2���Ƚ�d��e�������ӵİ뾶��С(�û�ѧʽ��ʾ,��ͬ):_______>__________��________�Ƚ�g��h������������Ӧˮ���������ǿ��:_______>__________��____________
��3����ѡ����Ԫ�����һ����ԭ�ӹ��ۻ����д�������ʽ:_________________��
��4��д��e�ĵ���������d2��ȼ�շ�Ӧ�Ļ�ѧ����ʽ:____________________________��
��5������Ԫ�ؿ������R:zx4f(gd4)2����ʢ��10 mL 1 mol��L��1R��Һ���ձ�����μ���1 mol��L��1NaOH��Һ�����������ʵ��������NaOH��Һ����ı仯ʾ��ͼ����:
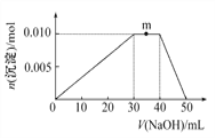
��д��m�㷴Ӧ�����ӷ���ʽ:____________________________��
������R��Һ�иļ�20 mL1.2 mol��L��1Ba(OH)2��Һ,��ַ�Ӧ��,��Һ�в������������ʵ���Ϊ_______mol��
���𰸡���3���ڢ�A�� r(O2��) r(Na��) HClO4 H2SO4 ![]() (��
(��![]() ��
��![]() �����������𰸾���) 2Na ��O2
�����������𰸾���) 2Na ��O2 ![]() Na2O2 NH4+��OH��NH3��H2O 0.022
Na2O2 NH4+��OH��NH3��H2O 0.022
��������
���Ȿ����Ҫ����Ԫ�ص����ʡ�
(1)��ԭ�Ӱ뾶����Դ�С�ͻ��ϼ��ж�f������f�����ڱ��е�λ���ǵ�3������A�塣
(2) ��ԭ�Ӱ뾶����Դ�С�ͻ��ϼ��ж�d������e���ƣ�O2����Na���ĵ��Ӳ�ṹ��ͬ�����Ӱ뾶���ź˵�����������С�����ӵİ뾶r(O2��) > r(Na��) ����ԭ�Ӱ뾶����Դ�С�ͻ��ϼ��ж�g����h���ȣ�g��h������������Ӧˮ���������ǿ����HClO4> H2SO4��
(3)����Ԫ����ɵ���ԭ�ӹ��ۻ�����ĵ���ʽ��![]() (��
(��![]() ��
��![]() �����������𰸾���)��
�����������𰸾���)��
(4)e�ĵ���������d2��ȼ�շ�Ӧ�Ļ�ѧ����ʽ��2Na ��O2 ![]() Na2O2��
Na2O2��
(5)R��NH4Al(SO4)2��ͼ�����η�����Ӧ��Al3++3OH��![]() Al(OH)3����
Al(OH)3����![]() +OH��
+OH��![]() NH3��H2O��Al(OH)3+OH��
NH3��H2O��Al(OH)3+OH��![]()
![]() +2H2O��
+2H2O��
��m�㷴Ӧ�����ӷ���ʽ��![]() +OH��
+OH��![]() NH3��H2O��
NH3��H2O��
������NaOH0.05mol��0.024molBa(OH)2����0.048molOH����0.024molBa2+��0.01molR����0.02mol![]() ��Ba(OH)2�ṩ��OH����NaOH����0.002mol����ӦAl(OH)3+OH��
��Ba(OH)2�ṩ��OH����NaOH����0.002mol����ӦAl(OH)3+OH��![]()
![]() +2H2O��Ϊ����0.002 molOH����ʣ��0.002mol Al(OH)3����ӦBa2++
+2H2O��Ϊ����0.002 molOH����ʣ��0.002mol Al(OH)3����ӦBa2++![]()
![]() BaSO4���е�
BaSO4���е�![]() ���㣬BaSO4�����ʵ�������
���㣬BaSO4�����ʵ�������![]() �����ʵ���Ϊ0.02mol�����������ʵ���Ϊ0.022mol��
�����ʵ���Ϊ0.02mol�����������ʵ���Ϊ0.022mol��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�ij�л����C��H��O����Ԫ�أ��������ģ����ͼ��ʾ�������й�������ȷ����
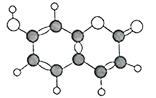
A. ����ʽΪC9H6O3
B. ����ʹ����KMnO4��Һ��ɫ
C. ������뺬1molNaOH����Һ��Ӧ
D. ����̼��������Һ��Ӧ�ų�CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ˮ�п��ܴ��ڵ���������:Na����Ag����Ba2����Al3����AlO2-��CO32-��S2����SO32-��SO42-����ȡ����Һ�����й�ʵ�飬ʵ����̼���������:

����˵����ȷ����
A. ����ʵ����е�������Ƴ�������Aһ���Ǵ��������ɫ����Aһ����AgBr
B. ����ʵ�����������Ƴ�����B��CO2������B��Al(OH)3��ԭ��Һ��һ������Al3��
C. ����ʵ����е�������Ƴ�������C��NH3������Cһ������BaCO3�����ܺ���BaSO4
D. ԭ��Һ�п϶�����Na����AlO2-��S2��������ȷ���Ƿ���SO32-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش��������⣺
���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1������ЩԪ���У���������ǿ��Ԫ����_______������õķǽ���Ԫ����_______��
��2����ѧ��������õ�Ԫ����__________����ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ_____________��
��3��Ԫ�ص�����������Ӧ��ˮ������������ǿ����______________��������ǿ����____________�������Ե�����������____________________��
��4���ۡ���Ԫ���У�ԭ�Ӱ뾶������________��ԭ�Ӱ뾶��С����____________��
��5���ڢ����ĵ����У���ѧ���ʽϻ��õ���_____________������ʲô��ѧ��Ӧ˵������ʵ��д����Ӧ�Ļ�ѧ����ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪԭ��������������Ķ�����Ԫ�أ���֪A��B��E 3��ԭ������㹲��11�����ӣ�����3��Ԫ�ص�����������ˮ�����������ܷ�����Ӧ�����κ�ˮ��CԪ�ص������������ȴ�����������4��DԪ��ԭ�Ӵ�����������������������3��
��1��д������Ԫ�ط��ţ�A _______ ��B________��C________��D________��E__________
��2��A��E��Ԫ�ؿ��γɻ�����õ���ʽ��ʾ�仯������γɹ��̣�____________ ��
��3��д��A��B��Ԫ������������ˮ�������Ӧ�Ļ�ѧ����ʽ��______________ ��
��4���Ƚ�C��D������������ˮ��������ԣ����û�ѧʽ��ʾ��_______________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���Ȼ���������ýȾ�����л��ϳ��е��Ȼ�������ʵ���ҿ������ڵ���(�۵�232��)��Cl2��Ӧ�Ʊ�SnCl4��װ����ͼ��

��֪:��SnCl2��SnCl4�й���������:
���� | ��ɫ��״̬ | �۵�/�� | �е�/�� |
SnCl2 | ��ɫ���� | 246 | 652 |
SnCl4 | ��ɫҺ�� | ��33 | 114 |
��SnCl4����ˮ������SnO2H2O��
�ش���������:
��1������a��������____________________________________________________________��װ��A�з�����Ӧ�����ӷ���ʽΪ________________________________________��
��2�����۲쵽װ��FҺ���Ϸ�______________ʱ�ſ�ʼ��ȼD���ľƾ��ƣ������ۻ����ʵ����������������������ȡ���ʱ�������ȵ�Ŀ����____________________________��
��3��������װ����ȱ��װ��C(��������ͬ)����D����֧�Թ��з�������Ҫ����Ӧ��ѧ����ʽΪ____________________________________________________________��
��4��Cl2�����ķ�Ӧ������SnCl4��SnCl2��Ϊ��ֹ��Ʒ�д�������SnCl2���ɲ�ȡ�Ĵ�ʩ��____________________________________________________________��
��5���ζ�������Ʒ��2��Sn(II)�ĺ���:�÷�����ƽ��ȡ5.000 g��Ʒ����ƿ�У�������ˮ�ܽ⣬���������Һ����0.1000 molL��1�ĵ����Һ�ζ����յ�ʱ����20.00 mL�����Ʒ��Sn(II)�ĺ���Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬѧ������ͼ��ʾװ����ʵ�����Ʊ�����������
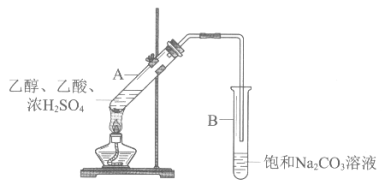
��1��ʵ���б���Na2CO3��Һ��������_______��
ij��ʵ��ʱ���ڱ���Na2CO3��Һ�еμ�2�η�̪��Һ��ʵ�������ȡ���Թ�B����ɫ��ȥ��Ϊ̽����ɫ��ԭ��������ʵ�顣
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | ��������� | ��������� | ��������á���Һ��ȡ�²���Һ�����뱥��Na2CO3��Һ |
���� | �ϲ�Һ��䱡��ð���ݣ��²���Һ��ɫ��ȥ | �ϲ�Һ�岻�䱡�������ݣ��²���Һ��ɫ��ȥ |
��2���Թܢ��в������ݵ�ԭ���ǣ��û�ѧ����ʽ���ͣ�_______��
��3���Ա�ʵ��ٺ͢ڿɵó��Ľ�����_______��
��4�����ʵ�����������ͬѧ������룺��̪������������������ʵ����й۲쵽_______��֤ʵ�ҵIJ�����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������(NaBiNO3)������Һ�е�Mn2+����Ӧ����ʽΪ��4MnSO4+10NaBiO3+14H2SO4�T4NaMnO4+5Bi2(SO4)3+3Na2SO4+�ڣ�����˵������ȷ����
A. ���ڵ�����Ϊˮ����ƽϵ��Ϊ14��
B. ������1mol NaMnO4����ת��5mole-
C. ��Ӧ����ʽ�е�����ɻ�Ϊ����
D. ��Һ����Mn2+����������Һ��Ϊ�Ϻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ�ⶨNa2CO3���壨������NaCl���Ĵ��ȣ��������װ�ã����Լ�������ʵ�顣
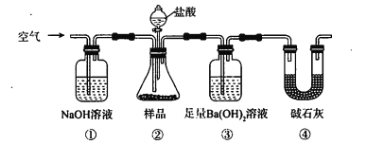
����˵������ȷ����
A. �����ڢڢۼ���������HCl��װ��
B. �ܵ������Ƿ�ֹ�����е�����Ӱ��ʵ��ľ�ȷ��
C. ͨ������������DZ�֤���в�����������ȫת�Ƶ�����
D. ��ȡ��Ʒ�͢��в����ij�����������������Na2CO3����Ĵ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com