
| A. | 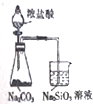 验证碳酸与硅酸的酸性 | B. | 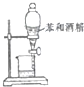 分离苯和酒精 | ||
| C. | 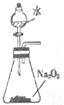 制取少量O2 | D. | 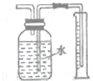 收集少量NO2气体 |
分析 A.盐酸易挥发,盐酸与硅酸钠反应;
B.苯和酒精互溶;
C.过氧化钠与水反应生成氧气,利用活塞控制水的加入;
D.二氧化氮与水反应.
解答 解:A.盐酸易挥发,盐酸与硅酸钠反应,则图中装置不能比较碳酸、硅酸的酸性,故A错误;
B.苯和酒精互溶,不能利用图中分液装置分离,应选蒸馏法,故B错误;
C.过氧化钠与水反应生成氧气,利用活塞控制水的加入,则可制备少量氧气,故C正确;
D.二氧化氮与水反应,图中装置不能收集少量NO2气体,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握图中实验装置的作用、物质的制备、混合物分离、酸性比较为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用及实验评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 平衡时,两个容器中NH3的体积分数均为25% | |
| C. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标准状况下,22.4 L氖气含有原子数为NA | |
| C. | 物质的量浓度为2 mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| D. | 标准状况下,11.2 L H2O含有0.5NA分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2═I2+2Br- | |
| C. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 | |
| D. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2═2Fe3++I2+4Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com