
| 时间/s | 0 | 50 | 100 | 150 |
| c(N2O5)/mol.L-1 | 2.50 | 1.76 | 1.25 | 1.25 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 50s内N2O5分解速率为1.48×10-2mol.L-1.s-1 | |
| C. | T1温度下的平衡常数为K1=15.625,平衡时N2O5的转化率为50% | |
| D. | 达到平衡后其他 条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)>2.50mol.L-1 |
分析 A.平衡常数只受温度影响,该反应正反应是吸热反应,升高温度,平衡向正反应移动,化学平衡常数增大;
B.根据v=$\frac{△c}{△t}$计算50s内N2O5分解速率;
C.100s、150s时,N2O5的浓度都是1.25mol/L,说明100s时反应到达平衡,利用三段式计算平衡时各组分的浓度、各物质的浓度变化量,代入平衡常数表达式K=$\frac{{c}^{4}(N{O}_{2})×c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$计算,N2O5的转化率=$\frac{{N}_{2}{O}_{5}浓度变化量}{{N}_{2}{O}_{5}起始浓度}$×100%;
D.到平衡后其他条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,压强增大一倍,平衡向逆反应方向移动.
解答 解:A.平衡常数只受温度影响,该反应正反应是吸热反应,升高温度,平衡向正反应移动,若T1>T2,则K1>K2,故A错误;
B.50s内N2O5的浓度变化量为2.5mol/L-1.76mol/L=0.74mol/L,故N2O5分解速率为$\frac{0.74mol/L}{50s}$=1.48×10-2mol/(L•s),故B正确;
C.100s、150s时,N2O5的浓度都是1.25mol/L,说明100s时反应到达平衡,则:
2N2O5(g)?4NO2(g)+O2(g)
开始(mol/L):2.5 0 0
变化(mol/L):1.25 2.5 0.625
平衡(mol/L):1.25 2.5 0.625
故该温度下,平衡常数k=$\frac{2.{5}^{4}×0.625}{1.2{5}^{2}}$=15.625,N2O5的转化率=$\frac{1.25mol/L}{2.5mol/L}$×100%=50%,故C正确;
D.达到平衡后其他 条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,若平衡不移动,则c(N2O5)=2.50mol.L-1,但压强增大一倍,平衡向逆反应方向移动,则c(N2O5)>2.50mol.L-1,故D正确,
故选A.
点评 本题考查化学反应速率计算、化学平衡影响因素、化学平衡平衡常数计算及影响因素等,难度中等,注意理解掌握外界条件对平衡移动的影响.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的$\frac{1}{2}$ | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,正反应速率减小,逆反应速率增大 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中滴加足量氨水 | |
| B. | 向酚酞试液中通入过量Cl2 | |
| C. | 向紫色石蕊试液中通入过量SO2 | |
| D. | 向酚酞试液中加入Na2O2粉末至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
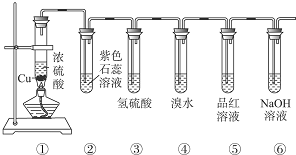
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
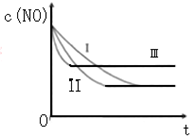 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
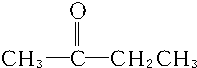 C:CH2═CH-CH2CH3或CH3CH═CH-CH3.
C:CH2═CH-CH2CH3或CH3CH═CH-CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
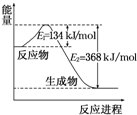 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com