
【题目】铝热反应常用来焊接钢轨。下图为实验室进行铝热反应的装置,点燃镁条,反应过程中看到熔融物落入蒸发皿的沙子中。则下列有关说法中正确的是
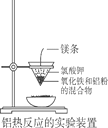
A. 金属氧化物与铝都能发生铝热反应
B. 该装置所用的漏斗是玻璃漏斗
C. 反应中观察到熔融物落入蒸发皿中,表明该反应是放热反应
D. 加氯酸钾的目的是用氯酸钾来氧化铝粉
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】取一小块金属钠放在燃烧匙中加热,下列实验现象描述正确的是( )
①金属钠先熔化②在空气中燃烧,产生黄色火焰 ③燃烧后得白色固体 ④燃烧后生成淡黄色固体物质
A.①②④B.①②③C.①②D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气部分氧化制取的化工原料气中,常含有氧硫化碳(COS,结构类似于CO2),目前氧硫化碳脱除可采用氢解和水解两种方法,其反应原理如下:
氢解:COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
水解:COS(g)+H2O(g)![]() H2S(g)+CO2(g)
H2S(g)+CO2(g)
(1)氧硫化碳的电子式为________________________________。
(2)如下图是氧硫化碳水解和氢解平衡转化率随温度变化曲线。
①观察图像,水解与氢解相比优势为_________________________________。
②水解的△H___0(填“大于"或“小于”)
③已知:1molCOS(g)完全氢解能量变化为6.99kJ,若初始COS的物质的量为nmol,从反应开始到R点所示体系的能量变化为______kJ(只列式,不必计算)。

(3)氢解和水解产生的H2S必须进行回收处理,酸性、可溶性铁盐氧化H2S制取硫磺工艺备受重视。
①写出酸性条件下用氢氧化铁溶液吸收H2S制取硫磺的离子方程式___________________________。
②吸收H2S后的酸性废液中的Fe2+,可通过电解法使Fe3+再生,写出电解时总反应的离子方程式:__________。
③常温下,在c(H+)=0.30mo/L的酸性溶液中通入H2S至饱和,测得硫化氢的平衡浓度为0.10mol/L,计算此时溶液中c(S2-)=_______[忽略H2S电离生成的H+,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15,结果保留两位有效数字。]
查看答案和解析>>
科目:高中化学 来源: 题型:
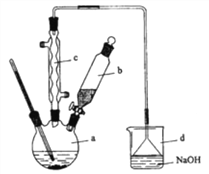
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生。请分别写出a仪器和c仪器的名称:_________________________、________________________________。
(2)请写出a中发生反应的化学方程式:___________________。d中倒置漏斗的作用是:_____,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型。试分析该同学的操作是否可行:______(填“是”或“否”),简要说明其原因:________________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
经以上分离操作后,粗溴苯中还含有的主要杂质为___,要进一步提纯,下列操作中必须的是____(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中正确的是( )
A. 化学键存在于原子之间,也存在于分子之间
B. 两个原子之间的相互作用叫做化学键
C. 离子键是阴、阳离子之间的相互吸引力
D. 化学键通常是指直接相邻的原子或离子之间强烈的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() _____(填“增大”“减小”或“不变”)。
_____(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式_____________;所得溶液的pH____(填“<”“>”或“=”)7,用离子方程式表示其原因___________________________
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,则c(SO42-)=________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是______________。
(5)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。
He | |||||||||||||||||
d | e | ||||||||||||||||
a | c | ||||||||||||||||
b | |||||||||||||||||
(1)请在图中用实线补全元素周期表的边界_________________________
(2)写出c在周期表中对应的位置________,并画出其原子结构示意图___________。
(3)相同大小的a、b两种元素的单质分别投入水中,反应较剧烈的是_______(用化学式表示, 下同),其与水反应的化学方程式为_________。
(4)比较d元素和e元素原子半径的大小_________(用“>”连接)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取肥皂的实验有以下步骤:
①在一个干燥的蒸发皿中加入植物油8mL、乙醇8mL、NaOH溶液4mL
②在不断搅拌下,给蒸发皿中液体微微加热,直到混合物变稠
③继续加热,直到皂化反应完成
④把盛混合物的蒸发皿放在冷水浴中冷却.等待片刻,向混合物中加20mL热蒸馏水,再放在冷水中冷却.然后加入25mL NaCl饱和溶液充分搅拌
⑤用纱布滤出固体物质,弃去滤液.把固体物质挤于、压成条状、晾干,即得肥皂
根据实验,填空:
(1)在制肥皂时加入乙醇是利用了乙醇的什么性质?_________;
(2)如何验证皂化反应已完成?_________;
(3)在操作④中加入饱和NaCl溶液的作用是_________;
(4)写出硬脂酸甘油酯发生皂化反应的化学方程式_________;
(5)取用蒸发皿用的仪器是_________;
(6)工业上大规模生产用水蒸气加热的优点_________ 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com