
【题目】下列鉴别物质的方法能达到目的的是
A. 用氨水鉴别MgCl2溶液和AlCl3溶液
B. 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
C. 用KSCN溶液鉴别FeCl3溶液和FeCl2溶液
D. 用淀粉溶液鉴别加碘盐和未加碘盐(己知加碘盐中添加的是KIO3)
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】利用下图装罝制取ClO2,并以ClO2为原料制备亚氯酸钠(NaClO2是—种高效氧化剂、漂白剂)。己知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaC1O2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
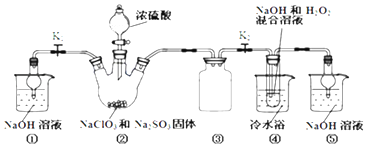
完成下列填空:
(1)装置②中产生ClO2的化学方程式为________。装置④中发生反应的离子方程式为_______。
(2)装置③的作用是_____________________。
(3)装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②___;③___;④低于60℃干燥,得到成品。
(4)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤:③用50℃左右的温水洗涤;④低于60℃干燥,得到成品。步骤③中用50℃左右的温水洗涤的原因______________________。
(5)①亚氯酸钠纯度测定:准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成250mL待测溶液。②取25.00mL待测液,恰好与20mL 2.0mol·L-1 Na2S2O3完全反应(I2 +2S2O32-=2I-+S4O62-),则该样品中NaClO2的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验事故或药品的处理方法正确的是
A. 实验台上的酒精灯被碰翻着火,立即用湿抹布扑灭
B. 用嘴吹灭酒精灯
C. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D. 将含硫酸的废液直接倒入水槽,用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13CNMR(核磁共振)、15NNMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获诺贝尔化学奖。下面有关叙述正确的是
A. 15N的核外电子数比中子数少1 B. 14N与14C互为同位素
C. 15N与14N为同一种核素 D. 13C与15N有相同的中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( ) 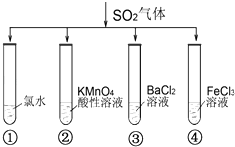
A.试管①中有淡黄色沉淀生成,说明SO2有氧化性
B.试管②中溶液褪色,说明SO2有漂白性
C.试管③中能产生白色沉淀,说明SO2有酸性
D.试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学的规角分析,下列说法不正确的是
A.锂离子电池是一种生活中常用的化学电源
B.纳米材料可用于制造不用洗的衣服面料
C.水中加入“催化剂”,可变成汽车燃料“油”
D.科学家未研发出只加水就能跑的“水氢发动机”汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A (g)+3B (g)![]() 2C (g)+2D (g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
2C (g)+2D (g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A. υ (A)=0.05mol/(Ls) B. υ (B)=0.06mol/(Lmin)
C. υ (C)=0.04mol/(Ls) D. υ (D)=0.03mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A(g)+B(g)![]() C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
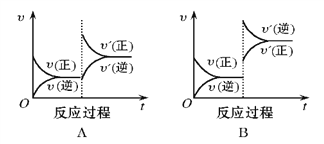
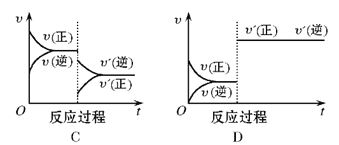

(1)升温,达到新平衡的是_________,新平衡中C的体积分数_________(填增大、减小或不变,下同) 。
(2)降压,达到新平衡的是__________,A的转化率__________。
(3)增加A的量,达到新平衡的是__________,此时B的转化率__________。
(4)使用催化剂,达到平衡的是__________, C的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为 .
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液. ①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论: .
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中. 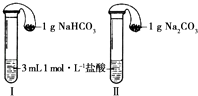
①两试管中均产生气体,(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应:(写离子方程式) |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32﹣浓度很小,不能与CaCl2反应 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com