
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
分析 (1)①根据基态Ti3+的核外电子排布式确定其未成对电子数;
②具有相同的电子数和原子数的微粒互为等电子体;阴阳离子之间存在离子键,非金属元素之间存在共价键,含有孤电子对的原子和含有空轨道的原子之间存在配位键;
③非金属的非金属性越强,其电负性越大;
(2)①电子层结构相同的离子,其离子半径随着原子序数的增大而减小;
②该元素的第III电离能剧增,则该元素属于第IIA族;
(3)根据C原子是成键类型判断;
(4)分子间氢键数目越多,则沸点越高;CH4分子间没有氢键,HF分子间只能形成链状结构;
(5)根据晶胞的结构计算纳米颗粒的表面原子占总原子数的百分比.
解答 解:(1)①基态Ti3+的核外电子排布式为1s22s22p63s23p63d1,其未成对电子数是1;
故答案为:1;
②具有相同的电子数和原子数的微粒互为等电子体,则BH4-的等电子体为NH4+;Li+和BH-4之间存在离子键,硼原子和氢原子之间存在共价键、配位键,所以该化合物中不含金属键;
故答案为:NH4+;C;
③非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为:H>B>Li;
(2)①Li+和H-的电子层结构相同,Li的原子序数大于H,所以离子半径:Li+<H-;
故答案为:<;
②该元素的第III电离能剧增,最外层电子数为2,则该元素属于第IIA族,为Mg元素;
故答案为:Mg;
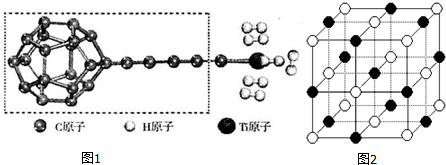
(3)图中虚线框内碳原子之间的化学键有C-C、C=C、C≡C,其杂化类型分别为sp3杂化、sp2杂化、sp杂化,所以杂化轨道类型有3种;
故答案为:3;
(4)分子间氢键数目越多,则沸点越高,已知H2O分子间氢键数比HF多,所以H2O沸点高;CH4分子间没有氢键不能形成“笼状结构”,每个HF只能形成2个氢键,所以HF分子间只能形成链状结构,
故答案为:H2O分子间氢键数比HF多,所以H2O沸点高;BC;
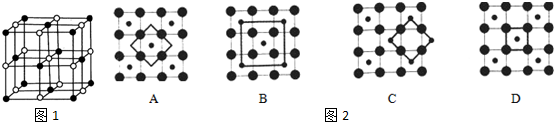
(5)由NaCl的晶胞图可知,NaCl的晶胞为正立方体结构,立方体的体心只有一个Na+,而其它的离子都处在立方体的面上,晶胞中的总原子数为27个,而表面上就有26个,故“NaCl”纳米颗粒的表面原子占总原子数的百分比为$\frac{26}{27}$×%=96.3%,故选C.
点评 本题考查物质结构和性质、晶胞的结构分析,会根据构造原理书写原子或离子核外电子排布式,题目涉及的知识点较多,难度较大.


科目:高中化学 来源: 题型:选择题
 ③
③
 ⑤CH≡CCH3 ⑥CH3(CH2)4CH3.
⑤CH≡CCH3 ⑥CH3(CH2)4CH3.| A. | ①②③④ | B. | ③④⑤ | C. | ①②④⑥ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z是第三周期电负性最大的元素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中SO2不能全部转化为SO3 | |
| B. | 无限增加反应时间,SO2能全部转化为SO3 | |
| C. | 达到化学平衡时,反应混合物中同时存在SO2、O2、SO3 | |
| D. | 达到化学平衡时,SO3的生成速率等于SO3的分解速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com