
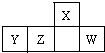
 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
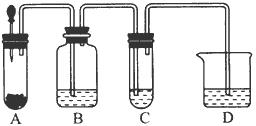 小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)
小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、Cl2既是氧化剂,又是还原剂 |
| B、3 mol氯气参加反应转移5 mol电子 |
| C、氧化产物的物质的量是还原产物的物质的量的5倍 |
| D、每有1 mol原子被氧化的同时就有5 mol原子被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某元素的原子半径是0.160 nm |
| B、某常见气体的密度为1.8 g/cm3 |
| C、某澄清石灰水的浓度是4.0 mol/L |
| D、某溶液中溶质的质量分数120% |
查看答案和解析>>
科目:高中化学 来源: 题型:
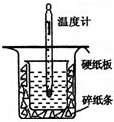 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题| 实验序号[来源:学#科#网] | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
| 3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:
实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+43.5 kJ/mol |
| B、-67.7 kJ/mol |
| C、+67.7 kJ/mol |
| D、-43.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| t/s | 0 | 500 | 1 000 |
| c(H2)/(mol?L-1) | 5.00 | 3.52 | 2.48 |
| c (CO)/(mol?L-1) | 2.50 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com