
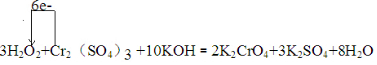 .
.分析 (1)根据氧化还原反应中得失电子数相等配平方程式,单线桥是指从失去电子的一方指向得到电子的一方,上面标注电子转移总数,此反应中铬元素化合价+3价变化为+4价,被氧化电子转移6e-;
(2)元素化合价降低的反应物做氧化剂被还原,元素化合价升高的反应物做还原剂被氧化;
(3)据3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O~6mole-,计算消耗50mL,1mol•L-1Cr2(SO4)3溶液中电子转移的数目.
解答 解:(1)一个双氧水分子参加氧化还原反应时得2个电子,一个铬离子参加氧化还原反应失去3个电子,所以得失电子的最小公倍数是6,则双氧水的计量数是3,铬离子的计量数是1,然后根据原子守恒配平其它原子,所以方程式3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O,故系数是3,1,10,2,3,8;单线桥是指从失去电子的一方指向得到电子的一方,上面标注电子转移总数,此反应中铬元素化合价+3价变化为+4价,被氧化电子转移6e-,用单线桥表示出该反应中电子转移的方向和数目的化学方程式为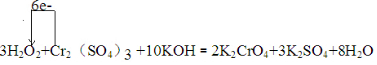 ,
,
故答案为:3;1;10;2;3;8;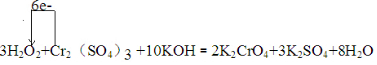 ;
;
(2)元素化合价降低的反应物做氧化剂被还原,其中H2O2中O元素化合价由-1降低到-2,故H2O2是氧化剂,
故答案为:H2O2;
(3)3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O~6mole-
1 6
1×0.05 0.3
故答案为:0.3mol.
点评 本题考查了氧化还原反应,侧重于氧化还原反应基本概念和电子转移的考查,注意掌握基本概念实质和规律的应用是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
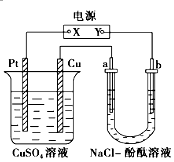 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-向正极移动 | |
| B. | 负极发生的电极反应是:O2+2CO2+4e-═2CO32- | |
| C. | 负极发生的电极反应是:CO+CO32--2e-═2CO2 | |
| D. | 正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
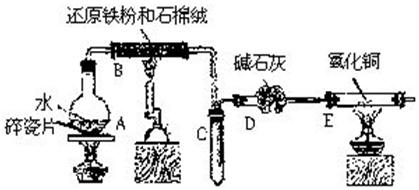
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
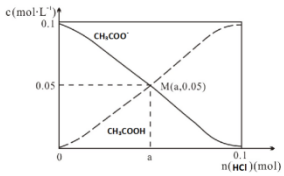
| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(H+)-n(OH-)=(0.05-a )mol | |
| C. | 随着HCl的加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小 | |
| D. | 当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质 |  甘蔗 |  生石灰 |  液氨 |  亚硝酸钠 |
| 用途 | 甘蔗渣可以制得酒精 | 干燥剂、抗氧化剂 | 制冷剂 | 食品防腐剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验A | 条件 | 现象 |
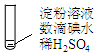 | 加热 | ⅰ.加热后蓝色褪去 ⅱ.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
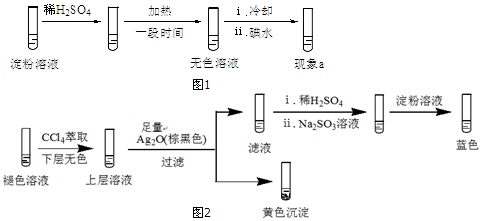
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com