
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I反应产物的定性探究
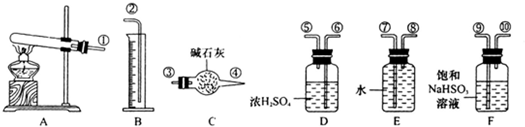
按下图装置(固定装置已略去)进行实验

(1)A中反应的化学方程式为:
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:

资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。
仅由上述资料可得出的正确结论是 。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 。 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
(14分)(1) Cu +2H2SO4(浓)= CuSO4 + SO2+ 2H2O (2分)
(2)NaOH溶液(或KMnO4溶液等) (2分)
(3)D装置中黑色固体颜色无变化,E中溶液褪色 (2分)
(4)将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌 (2分)
(5)使用上述装置,不放入铜丝进行实验,观察无水硫酸铜是否变蓝 (2分)
(6)abd
(7)(64bV/a)% (2分)
【解析】
试题分析:⑴铜与浓硫酸的反应Cu +2H2SO4(浓)  CuSO4
+ SO2↑+ 2H2O,故答案为:Cu +2H2SO4(浓)
CuSO4
+ SO2↑+ 2H2O,故答案为:Cu +2H2SO4(浓)  CuSO4
+ SO2↑+ 2H2O;⑵F为尾气吸收装置,通常用NaOH溶液或KMnO4溶液,答案:NaOH溶液(或KMnO4溶液等);⑶如果有H2产生,则D中固体变红,E溶液不褪色,所以如产生SO2,则D装置中黑色固体颜色无变化,E中溶液褪色,证明浓硫酸中硫元素的氧化性强于氢元素。答案:D装置中黑色固体颜色无变化,E中溶液褪色;⑷含有Cu2+ 的稀溶液的颜色为蓝色,所需的操作是将含浓硫酸的混合溶液稀释。答案:将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌。⑸控制反应条件,使反应不产生SO2,进行对比实验。答案:使用上述装置,不放入铜丝进行实验,观察无水硫酸铜是否变蓝。⑹a正确,反应中有黑色的固体产生,生成物不止一种,反应不止一个;b从资料1的表中看出浓硫酸浓度在16mol/L以下时,加热后黑色的固体可能消失,b正确;c反应只要是浓硫酸,资料中没有强调硫酸浓度≥15
mol·L-1,c不正确;d从表中看出.硫酸浓度越大,黑色固体出现的温度越低,黑色物质越快出现、消失所需温度越高,甚至不消失,d正确,选a b d.。
CuSO4
+ SO2↑+ 2H2O;⑵F为尾气吸收装置,通常用NaOH溶液或KMnO4溶液,答案:NaOH溶液(或KMnO4溶液等);⑶如果有H2产生,则D中固体变红,E溶液不褪色,所以如产生SO2,则D装置中黑色固体颜色无变化,E中溶液褪色,证明浓硫酸中硫元素的氧化性强于氢元素。答案:D装置中黑色固体颜色无变化,E中溶液褪色;⑷含有Cu2+ 的稀溶液的颜色为蓝色,所需的操作是将含浓硫酸的混合溶液稀释。答案:将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌。⑸控制反应条件,使反应不产生SO2,进行对比实验。答案:使用上述装置,不放入铜丝进行实验,观察无水硫酸铜是否变蓝。⑹a正确,反应中有黑色的固体产生,生成物不止一种,反应不止一个;b从资料1的表中看出浓硫酸浓度在16mol/L以下时,加热后黑色的固体可能消失,b正确;c反应只要是浓硫酸,资料中没有强调硫酸浓度≥15
mol·L-1,c不正确;d从表中看出.硫酸浓度越大,黑色固体出现的温度越低,黑色物质越快出现、消失所需温度越高,甚至不消失,d正确,选a b d.。
⑺ 根据方程式2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-,
得关系式Cu2+ ― S2O32―
c×25 bv
n(Cu2+
)=
则硫酸铜的产率为:实际产量÷理论产量×100%=
考点:元素化合物知识、基本实验实验、化学反应原理、氧化还原反应、化学计算等综合性较强。中等难度。


科目:高中化学 来源: 题型:阅读理解
| 氧气 |
| △ |
| 稀H2SO4 |
| 硫酸亚铁 |
| 硝酸银 |
| 氢氧化钠 |
| 稀硫酸 |
| 浓H2SO4 |
| △ |
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省高三起点考试化学试卷 题型:实验题
(12分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
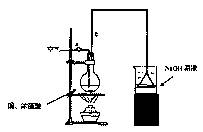
(1)烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的 (填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行___ _、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是 。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因: ,
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三第一次摸底考试化学试卷 题型:实验题
(12分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
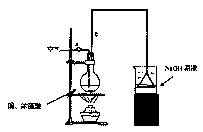
(1)烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的 (填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行___ _、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是 。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因: ,
。
查看答案和解析>>
科目:高中化学 来源: 题型:
某教师在课堂上用右图所示
的装置来验证浓硫酸与铜是否发生反
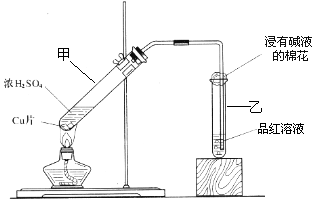 应,并探讨反应所产生气体的性质。请
应,并探讨反应所产生气体的性质。请
回答下列问题:
(1)通过试管乙中发生的
现象说明了铜和浓硫酸发生了化学反应,
并且该现象还能说明产生的气体具有 性。
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目。
。
(3)试管乙口部浸有碱液的棉花的作用是 ,此防范措施也说明产生的气体是 (填“酸性”、“中性”或“碱性”)气体, (填“有”或“无”)毒性。
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5 mol/L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
①该雨水中共溶解SO2的体积是 mL(标准状况)。
②若生成沉淀物的质量为4.50 g,则沉淀物的组成为 (填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
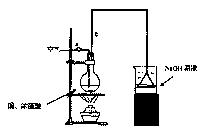
(1)烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的 (填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行___ _、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是 。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因: ,
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com