

| A. | 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生 | |
| C. | 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀 |
分析 A.图②中惰性电极为阴极;
B.图②阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑;
C.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,以此计算.
解答 解:A.图②中惰性电极为阴极,Fe电极为阳极,则Cr2O2-7离子向金属铁电极移动,与亚铁离子发生氧化还原反应生成的金属阳离子与惰性电极附近的OH-结合转化成Cr(OH)3除去,故A错误;
B.图②图乙的电解池中,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑,则n(Fe)=$\frac{0.084g}{56g/mol}$=0.0015mol,阴极气体在标况下的体积为0.0015mol×22.4L/mol=0.0336L=33.6mL,未指明标况,故B错误;
C.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应,则总反应减去负极反应可得正极还原反应为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,故C正确;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,则n(Mg)=$\frac{3.6g}{24g/mol}$=0.15mol,理论可产生氢氧化铁沉淀的质量为0.15mol×107g/mol=16.05g,故D错误;
故选C.
点评 本题综合考查电解原理,涉及电解、氧化还原反应、电子守恒的计算等问题,为高频考点,要求具有较好的分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HBr<HCl<HF | B. | 原子半径:I<Br<Cl | ||
| C. | 酸性:HClO4<HBrO4<HIO4 | D. | 非金属性:F<Cl<Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别与其他分散系的本质特征是分散质的粒子直径在1-100nm之间 | |
| B. | 用平行光照射CuSO4溶液和氢氧化铁胶体,不可以加以区分 | |
| C. | 胶体是纯净物 | |
| D. | 树林中的晨曦,该现象与丁达尔效应无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{vn}{22.4}$ | B. | $\frac{22.4n}{v}$ | C. | $\frac{vn}{5.6}$ | D. | $\frac{22.4n}{3v}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 250C101KPa条件下,1摩尔任何气体的体积都是22.4升 | |
| B. | 标准状况下,体积是22.4升的物质,其物质的量一定是1摩尔 | |
| C. | 同温同压下两种气体,只要分子数相同,所占体积相同,质量也相同 | |
| D. | 同质量的O2和O3所含的氧原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol N2所含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 标准状况下,22.4 LHF所含的分子数为NA | |
| D. | 24 g O2分子和24 g O3分子所含的分子数不相等,氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
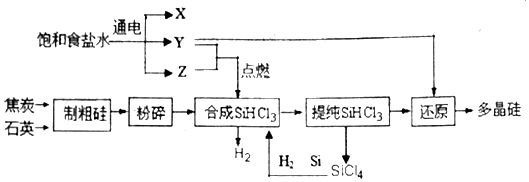
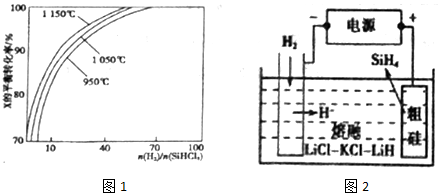
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com