
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的电子式为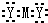 | B. | Z可表示为M2Y | C. | Z一定溶于水中 | D. | M形成+2价阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气在空气中燃烧的反应 | |
| B. | 灼热的木炭与CO2的反应 | |
| C. | 铁粉与稀硫酸的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Br2(g)?2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变 | |
| B. | 2NO2(g)?N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变 | |
| C. | CaCO3(s)?CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变 | |
| D. | 3H2(g)+N2(g)?2NH3(g) 反应体系中H2与N2的物质的量之比保持3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将铁片放入浓硫酸中 | 无明显现象 | 铁片发生了钝化 |
| B | 将SO2通入Na2CO3溶液中,将产生的气体再通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明酸性: H2SO3>H2CO3>H2SiO3 |
| C | 向含有Fe3+的溶液中滴加KSCN溶液 | 溶液变红色 | 有Fe(SCN)3生成 |
| D | 向KOH溶液中滴加FeCl3溶液 | 有红褐色沉淀生成 | OH-+Fe3+=Fe(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
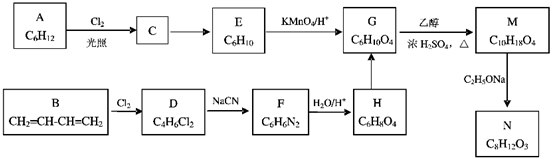
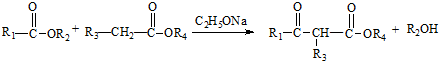
 .
.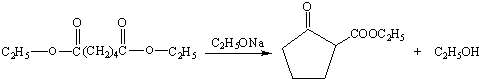 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 | |
| B. | 在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的是H2O | |
| C. | 第二周期元素的最高正化合价都等于其原子的最外层电子数 | |
| D. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com