
| A、钢铁在潮湿的空气中比在干燥空气中更容易生锈 |
| B、用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 |
| C、蒸馏水和0.1mol?L-1 NaOH溶液中的c(H+),前者大于后者 |
| D、向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
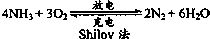 以氨气代替氢气来研发氨燃料电池是当前科研的一个热点.氨燃料电池使用的电解质溶液是KOH溶液,电池反应如图:有关下列说法错误的是( )
以氨气代替氢气来研发氨燃料电池是当前科研的一个热点.氨燃料电池使用的电解质溶液是KOH溶液,电池反应如图:有关下列说法错误的是( )| A、氨燃料电池在充电时,OH-向电池的负极移动 |
| B、氨燃料电池在放电时,负极反应为:2NH3-6e-+6OH-═N2+6H2O |
| C、以氨气代替氢气的主要原因是:氨气易液化易储存 |
| D、燃料电池的能量转化率一般比普通的电池高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的裂解为深度裂化,产物主要为乙烯等小分子烃 |
| B、油脂“硬化”后性质变的更稳定 |
| C、蔗糖、淀粉、纤维素均会水解,反应后的产物相同 |
| D、2CH3CH2OH+O2→2CH3CHO+2H2O属于氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为CH4O和C2H6O的物质不一定互为同系物 |
| B、通过乙烷的取代反应或乙烯的加成反应都可以制取纯净的氯乙烷 |
| C、淀粉.纤维素都属于糖类,它们通式相同,但它们不互为同分异构体 |
| D、某有机化合物仅由C.H.O三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中碳原子的个数最多为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| v(A) |
| a |
| v(B) |
| b |
| v(D) |
| d |
| v(E) |
| e |
| 实验编号 | 1 | 2 | 3 | 4 |
| c(HI)/mol?L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
| c(H2O2)/mol?L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
| v/mol?L-1?s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
| A、实验1、2中,v(H2O2)相等 |
| B、将浓度均为0.200mol?L-1 H2O2和HI溶液等体积混合,反应开始时v=0.0304mol?L-1?s-1 |
| C、v与“HI和H2O2浓度的乘积”的比值为常数 |
| D、实验4,反应5秒后H2O2浓度减少了0.0755mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、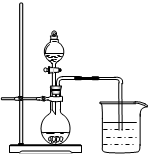 向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、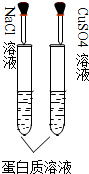 两支试管中蛋白质溶液均会变性 |
C、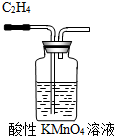 除去C2H4中的SO2 |
D、 海带灼烧成灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com