
下列关于有机物说法正确的是 ( )
A.制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中
B.纤维素和淀粉都是多糖,二者互为同分异构体
C.煤的干馏是物理变化,煤的气化和液化是化学变化
D.三大合成材料是塑料、合成纤维和合成橡胶
科目:高中化学 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:实验题
(15分)乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
乙酰苯胺的制备原理为: 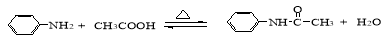
实验参数:
名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
苯 胺 | 93 | 无色油状液体, 具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
实验装置:(见右图)
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
实验步骤:
步聚1:在100ml圆底烧瓶中加入无水苯胺9.1mL,冰醋酸17.4mL,锌粉0.1g,安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,
调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步聚2: 在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步聚3: 将此粗乙酰苯胺进行重结晶,待结晶完全后抽滤,尽量压干滤饼。产品放在干净的表面皿中晾干,称重,计算产率。
请回答下列问题:
(1)实验中加入锌粉的目的是
(2)为何要控制分馏柱上端的温度在105?C左右
(3)通过什么现象可判断反应基本完成
(4)步聚1加热可用 (填“水浴”或“油浴”),步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是 。
(5)洗涤乙酰苯胺粗品最合适的试剂是 。
A. 用少量冷水洗 B. 用少量热水洗
C. 先用冷水洗,再用热水洗 D. 用酒精洗
(6)该实验最终得到纯品8.1克,则乙酰苯胺的产率是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:选择题
在反应Cu+2 H2SO4(浓) 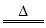 CuSO4+SO2↑+2H2O中,还原剂是
CuSO4+SO2↑+2H2O中,还原剂是
A.C u B.H2SO4 C. CuSO4 D.SO2
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期中化学试卷(解析版) 题型:选择题
三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下:
下列化合物中,经过烯烃复分解反应可以生成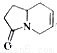 的是 ( )
的是 ( )
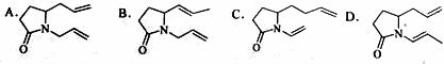
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.按系统命名法,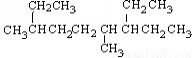 名称:4,7-二甲基-3-乙基壬烷
名称:4,7-二甲基-3-乙基壬烷
B.元素分析仪可以同时对碳、氢、氧、硫等多种元素进行分析
C.用相同浓度的乙醇和苯酚水溶液,分别与相同质量的金属钠反应,来比较两者羟基上氢的活性
D.有机高分子化合物糖类、油脂和蛋白质都是人体必需的营养物质
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期中化学试卷(解析版) 题型:实验题
(6分)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反 应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值________(填“偏 大”、“偏小”或“无影响”);
(3)实验中改用60 mL 0.50 mol/L 盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期中化学试卷(解析版) 题型:选择题
对反应A+B AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是 ( )
A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省杭州市高二年级教学质量检测模拟卷化学试卷(解析版) 题型:实验题
(9分)某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发。为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验。请回答相关问题。
(1)为了探究SO2能否使品红褪色,该同学选择了正确的药品后,设计了如下图所示实验装置,请指出实验装置图设计中的不合理之处。
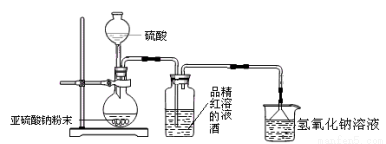
① ;
② 。
(2)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。为此,你认为使品红的水溶液褪色的微粒可能是 。
(3)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出结论:使品红褪色的微粒肯定是HSO3-或SO32-。你认为他的结论是否正确 , 其理由是 。
(4)再用以下装置探究SO2的某些化学性质。

①装置乙的作用是 。
②若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性
c.漂白性 d.不稳定性
③若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
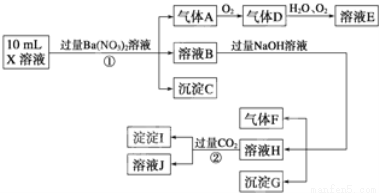
某强酸性溶液X可能含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO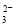 、SO
、SO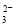 、SO
、SO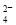 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行连续实验,实验过程如下:
中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是______,不能确定是否含有的离子(M)是______,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是______.
(2)写出反应②的离子方程式:______.
(3)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式______.
(4)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com