
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O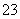 +O2+aOH-===Y+S4O
+O2+aOH-===Y+S4O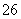 +2H2O,下列说法中,不正确的是( )
+2H2O,下列说法中,不正确的是( )
A.a=4
B.Y的化学式为Fe2O3
C.S2O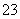 是还原剂
是还原剂
D.每有1 mol O2参加反应,转移的电子为4 mol
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
化学与生活密切相关,下列情况会对人体健康造成较大危害的是
A.用Cl2对自来水进行消毒杀菌
B.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
C.用SO2漂白食品
D.用小苏打(NaHCO3)发酵面团制作馒头
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。NF3沸点-129 ℃,可在铜的催化作用下由F2和过量NH3反应得到。
(1) NF3分子构型: ,N原子杂化方式: 。
(2)写出制备 NF3的化学反应方程式: 。
(3)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是 。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 。
(5)1~36元素中原子核外电子排布未成对电子数最多的元素其外围电子排布式为_____,有_________个能级;某元素原子的价电子为3d14s2,元素名称为_________,最高正化合价为_______;请写出有2个能层且p轨道中只有一个成对电子的基态原子的外围电子排布图__________________。
(6)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①若以上五种元素为前四周期元素,则R为_____________。(填元素符号)
②若五种元素为主族元素,则T为__________区元素。
③若T为第三周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA代表阿伏加德罗常数的数值,下列说法正确的是 ( )。
A.标准状况下,22.4 L CHCl3中含有的氯原子的数目为3NA
B.7 g CnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.0.5 mol·L-1 Na2CO3溶液中含有的CO32 -的数目为0.5NA
-的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.H、D、T属于同位素,H2、D2、T2属于同素异形体
B.氯水、氨水、王水是混合物,水银、水玻璃是纯净物
C.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质
D.水能、风能是可再生能源,煤、石油、天然气是不可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25 mL 0.1 mol/L Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O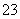 将转化为( )
将转化为( )
A.SO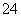 B.SO
B.SO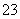
C.S D.S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)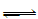 N2(g)+2CO2(g),下列说法中正确的是 ( )
N2(g)+2CO2(g),下列说法中正确的是 ( )
A.使用适当的催化剂不改变反应速率 B.降低压强能提高反应速率
C.升高温度能提高反应速率 D.改变压强对反应速率无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是 ( )
A.产生气体的体积:(1) > (2)
 B.电极上析出物质的质量:(1) > (2)
B.电极上析出物质的质量:(1) > (2)
C.溶液pH的变化:(1)增大,(2)减小
D.电极反应式:(1)中阳极:4OH--4e-===2H2O+O2↑,
(2)中负极:2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若1 mol KNO3反应,则下列说法正确的是
A.N2是还原产物
B.KNO3被氧化
C.转移电子的物质的量为5 mol
D.被氧化的N原子的物质的量为1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com