
为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
|
| 物质 | 试剂 | 分离方法 |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
A.①③ B.①④ C.② D.③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列各组反应中,不能用同一个离子方程式表示的是( )
|
| A. | 盐酸分别与NaOH溶液、Ca(OH)2溶液反应 |
|
| B. | 锌分别与稀盐酸、稀硫酸反应 |
|
| C. | 硝酸分别与Na2CO3溶液、K2CO3溶液反应 |
|
| D. | 硫酸分别与NaOH溶液、Ba(OH)2溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活密切相关,下列有关说法不正确的是( )
A.使用含有氯化钠的融雪剂会加快桥梁的腐蚀
B.可溶性铜盐有毒,故人体内不存在铜元素
C.在海轮外壳装上锌块,可减缓船体的腐蚀速率
D.中秋佳节月饼中用小袋包装的铁粉来防止月饼氧化变质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验或反应中,最后固体质量增加的是( )
A.铜丝在空气中灼烧后迅速伸入乙醇蒸气中
B.铁粉与硫粉物质的量之比为1:1时混合加热
C.锌粉加入到氯化铜溶液中
D.去除氧化膜的铝条插入到浓硝酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
2KNO3 2KNO2↑+O2↑ 2Cu(NO3)2
2KNO2↑+O2↑ 2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
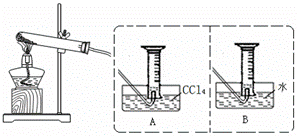 I:【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。①向一份溶液中滴入少量KSCN溶液;②少量稀酸性KMnO4溶液中滴入另一份溶液。现象:①溶液变红色②溶液变红色
I:【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。①向一份溶液中滴入少量KSCN溶液;②少量稀酸性KMnO4溶液中滴入另一份溶液。现象:①溶液变红色②溶液变红色
(1)则Fe(NO3)2分解的化学方程式是 。
II:【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重新连接好仪器;④加热;⑤……
(2)乙同学使用A装置收集气体,恰好收集到54mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是 。
(3)丙同学取等质量Fe(NO3)2的在同样条件下热分解,用B装置收集气体产物,可收集到气体___________mL。
III:【实验三】探究固体混合物的组成和特征
(4)小组丁同学取KNO3、 Cu(NO3)2、 Fe(NO3)2混合粉末充分加热后用排水法未收集到任何气体,则KNO3、 Cu(NO3)2、 Fe(NO3)2物质的量之比可能为_____________。
A. 1∶2∶2 B. 2∶1∶3 C. 1∶2∶3 D. 3∶8∶5
(5)取0.6mol由KNO3、 Cu(NO3)2、 Fe(NO3)3按等物质的量之比混合而成的粉末溶于100mL 3mol/L的稀硫酸中,再向溶液中加入足量的铜粉,则最多可溶解铜粉质量为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是
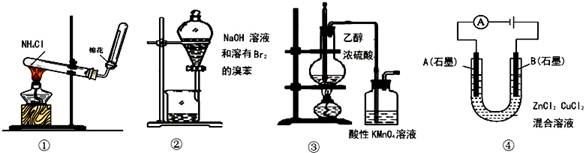
| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | B极上有红色固体析出 | 锌的金属性比铜强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验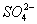 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验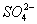 的操作是_____________。
的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com