


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在氯气中剧烈燃烧,生成黑烟 | ||||
| B、钠熔化成小球,与氯气缓慢反应,有蓝色火焰 | ||||
C、该反应的化学方程式为:Na+Cl
| ||||
| D、反应后,钠原子失去电子变成钠离子,氯原子得到电子变成氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:9 | B、9:1 |
| C、10:1 | D、1:10 |
查看答案和解析>>
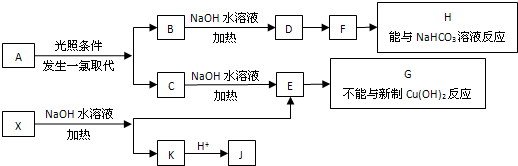
科目:高中化学 来源: 题型:
 ⑥-C6H5 ⑦Br-⑧-COOH 其中不是官能团的是( )
⑥-C6H5 ⑦Br-⑧-COOH 其中不是官能团的是( )| A、①③⑤⑧ | B、②④⑦ |
| C、②③⑤⑦⑧ | D、②④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将0.2 mol?L-1的某一元酸HA溶液和0.1 mol?L-1 NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH一)+c(A-)═2c(H+)+c(HA) |
| B、某溶液中存在的离子有Cl-、OH-、NH4+、H+,则离子浓度不一定是c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、某物质的溶液中由水电离出的c(H+)=1×10-a mol?L-1,若a>7时,则该溶液的pH一定为14-a |
| D、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR一)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液氨汽化时要吸收大量的热,可用作制冷剂 |
| B、生石灰能与水反应,可用干燥氯气 |
| C、维生素C受热易被氧化,所以有些新鲜蔬菜生吃较好 |
| D、氮气的化学性质不活泼,可用作粮食和食品仓库的保护气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
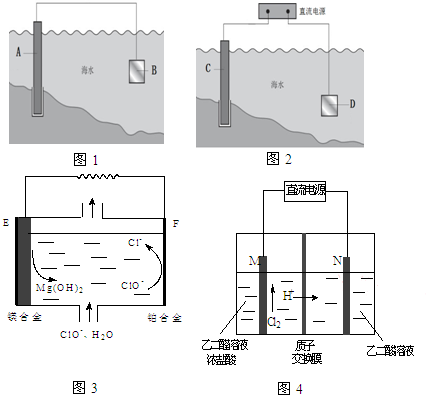 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com