
| A. | 氢键有方向性和饱和性,属于共价键 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 范德华力是一种分子间作用力,也是一种特殊的化学键 | |
| D. | 常温常压下,卤素单质从F2→I2由气态、液态到固态的原因是范德华力逐渐增大 |
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
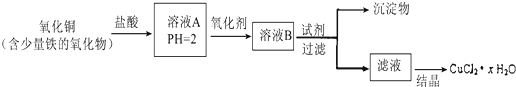
科目:高中化学 来源: 题型:解答题
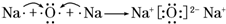 .A、B两种元素还可以形成A2B2型化合物,写出该化合物的电子式
.A、B两种元素还可以形成A2B2型化合物,写出该化合物的电子式 .
. ;
;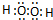 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应前 | 反应后 | ||
| 实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 134.4 g | 10 g | 141.1 g | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 | |
| B. | 紫色晶体配合物的化学式为[Ti(H2O)6]Cl3 | |
| C. | 上述两种晶体的分子式相同,但结构不同,所以性质不同 | |
| D. | 0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到 2.78 g 沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使品红溶液褪色 | B. | 能与NaOH溶液反应 | ||
| C. | 能与H2O反应生成H2SO4 | D. | 一定条件下能与O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | -57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com