
 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.分析 (1)根据题意写出化学方程式,再根据盖斯定律运用“加减法”求算此反应的焓变;
(2)a极将水反应生成氧气,氧元素化合价升高,失去电子,所以为负极.b为正极,是二氧化碳得到电子生成甲酸,据此解答;
(3)标准状况下2.24LCO2的物质的量为0.1L,1.5mol/LNaOH溶液中含有0.15molNaOH,二者恰好发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O,反应后生成了等浓度的碳酸钠和碳酸氢钠,然后结合盐的水解原理判断各离子浓度大小;
(4)①碳酸钙与二氧化硫、氧气反应生成硫酸钙和二氧化碳;
②②Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=5.0×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:(1)①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H1=-860.0kJ•mol-1;
②2NO2(g)?N2O4(g)△H2=-66.9kJ•mol-1,
依据盖斯定律①-②得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=△H1-△H2=-793.1kJ/mol;
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-793.1 kJ/mol;
(2)a极将水反应生成氧气,氧元素化合价升高,失去电子,所以为负极,b为正极,是二氧化碳得到电子生成甲酸,电极反应为:CO2+2H++2e-=HCOOH;
故答案为:负极;CO2+2H++2e-=HCOOH;
(3)标准状况下,2.24LCO2的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
100mL 1.5mol/LNaOH溶液中含有0.15molNaOH,二者发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O生成等浓度的Na2CO3、NaHCO3,HCO3-、CO32-部分水解,溶液呈碱性,则c(OH-)>c(H+),由于CO32-水解程度大于HCO3-,则c(HCO3-)>c(CO32-),所以反应后溶液中的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)①石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙及鼓入的空气反应生成石膏(CaSO4•2H2O),即碳酸钙与二氧化硫、氧气反应生成硫酸钙和二氧化碳,其反应的方程式为:2CaCO3+2SO2+O2+4H2O═2(CaSO4•2H2O)+2CO2;
故答案为:2CaCO3+2SO2+O2+4H2O═2(CaSO4•2H2O)+2CO2;
②Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×10{\;}^{-9}}{1×10{\;}^{-4}}$mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为5.6×10-5mol/L;
故答案为:5.6×10-5mo1/L.
点评 本题考查了反应热的计算、电极判断及电极反应式的书写、离子浓度大小比较、难溶电解质的溶解平衡,明确盖斯定律计算反应热方法、原电池工作原理、碳酸钠和碳酸氢钠水解性质、溶度积规则是解题关键,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(取代反应) | |
| B. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH(加成反应) | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O(取代反应) | |
| D. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O(加成反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的酸性:W>Z>X | |
| B. | 化合物Q有强氧化性 | |
| C. | Z、X都可以形成两种常见的酸性氧化物 | |
| D. | 四种元素的常见单质中X的单质的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
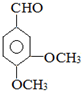
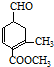 )、乙(
)、乙(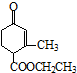 )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )| A. | 可用新制的氢氧化铜悬浊液区分这两种有机物 | |
| B. | 1 mol甲与H2在一定条件下反应,最多消耗3 mol H2 | |
| C. | 甲、乙互为同分异构体 | |
| D. | 等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
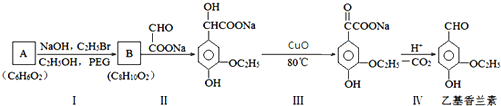
 .
.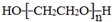 .若PEG的平均相对分子质量为17618,则其平均聚合度约为400.
.若PEG的平均相对分子质量为17618,则其平均聚合度约为400.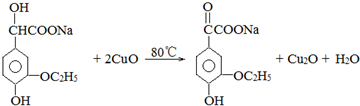 .
.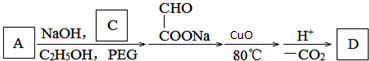
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应Ⅰ的离子方程式为2OH-+Al2O3═2AlO2-+H2O | |
| B. | 操作a的内容包括:通入过量CO2、过滤、洗涤、灼烧 | |
| C. | 操作b为电解熔融状态的Al2O3或用CO还原Al2O3 | |
| D. | 固体b灼烧后与铝反应可用于工业上冶炼相应的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com