

请填写下列空白:
(1)反应(Ⅱ)的化学方程式是________。
(2)反应(Ⅲ)的化学方程式是________,其中氧化剂与还原剂的物质的量之比为________。
(3)反应(Ⅳ)的化学方程式是________。
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:阅读理解
| 化学键 | N≡N | H-O | N-H | O=O |
| 键能/kJ?mol-1 | 945 | 463 | 391 | 498 |
 2NH3(g)+
2NH3(g)+| 3 |
| 2 |
 2NH3(g)+
2NH3(g)+| 3 |
| 2 |
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6mol/L) | 4.8 | 5.9 | 6.0 |
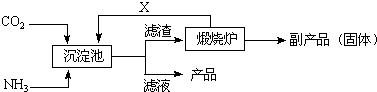
查看答案和解析>>
科目:高中化学 来源: 题型:
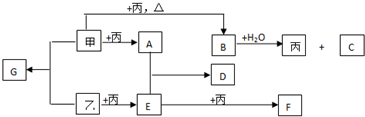
查看答案和解析>>
科目:高中化学 来源: 题型:

请填写下列空白:
(1)反应(Ⅱ)的化学方程式是____________________________________________;
(2)反应(Ⅲ)的化学方程式是______________,其中氧化剂与还原剂的物质的量之比为________;
(3)反应(Ⅳ)的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知生石灰(CaO)与碳在2700℃高温作用下,可制得电石,现以石灰石(主要成分![]() )为起始的原料,按下图制取乙炔气体。
)为起始的原料,按下图制取乙炔气体。
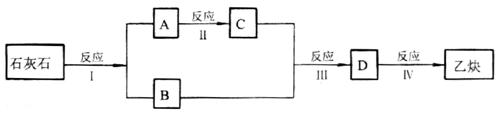
请填写下列空白:
(1)反应(Ⅱ)的化学反应方程式是:___________________
(2)反应(Ⅲ)的化学反应方程式是:_________________;其中氧化剂与还原剂的物质的量之比为__________;
(3)反应(Ⅳ)的化学方程式是:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com