
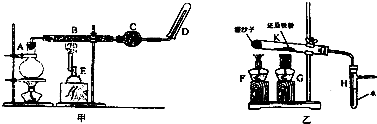
分析 I.(1)将H中加入水没过导管口,利用微热法检验气密性;
(2)加热湿沙子可提供水蒸气;
(3)B处Fe与水蒸气反应生成四氧化三铁和氢气;
(4)装置H可使水蒸气与氢气分离;
(5)对比甲、乙两装置的B和K可知,B中使用石棉绒,增大水蒸气与Fe粉接触面积;
II.①甲中长导管进气,无法将水排出,乙可排水收集;
②n(H2)=$\frac{V}{22.4}$mol,由3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2可知,n(Fe)=$\frac{V}{22.4}$mol×$\frac{3}{4}$,以此计算;
③若反应中Fe剩余,Fe与铁离子反应.
解答 解:Ⅰ.(1)检查乙装置的气密性的方法为向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好,
故答案为:向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好;
(2)乙装置中湿沙子的作用是提供水蒸气,
故答案为:提供水蒸气;
(3)B处发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(4)乙装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是冷凝水蒸气,与氢气分离,
故答案为:冷凝水蒸气;
(5)对比甲、乙两装置的B和K,B的优点是使用石棉绒,增大水蒸气与Fe粉接触面积,加快反应速率,
故答案为:使用石棉绒,增大水蒸气与Fe粉接触面积,加快反应速率;
Ⅱ.①甲中长导管进气,无法将水排出,乙可排水收集,故答案为:乙;
②n(H2)=$\frac{V}{22.4}$mol,由3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2可知,n(Fe)=$\frac{V}{22.4}$mol×$\frac{3}{4}$,铁粉的转化率为$\frac{\frac{V}{22.4}mol×\frac{3}{4}×56g/mol}{m}$×100%,
故答案为:$\frac{\frac{V}{22.4}mol×\frac{3}{4}×56g/mol}{m}$×100%;
③若反应中Fe剩余,Fe与铁离子反应,则现象不能说明反应后的固体混合物中不含有+3价Fe,其理由为铁粉可能有剩余,剩余铁粉会与Fe3+反应,将Fe3+溶液中完全还原为Fe2+,故答案为:铁粉可能有剩余,剩余铁粉会与Fe3+反应,将Fe3+溶液中完全还原为Fe2+.
点评 本题考查性质实验方案的设计,为高频考点,把握实验装置的作用、物质的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | Y |
| Z |
 .
.| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI═Z↓+2I2+1H2O |
| ① | 酸性 | H2SeO3+2NaOH=Na2SeO3+2H2O |
| ② | 还原性 | H2SeO3+Cl2+H2O=H2SeO4+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
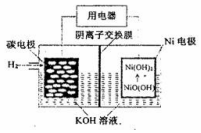
| A. | 放电时,OH-向碳电极迁移 | |
| B. | 放电时,负极反应NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,镍电极与电极的正极相连 | |
| D. | 充电时,碳电极区溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高价铁盐可用于硬水的软化 | |
| B. | 钾、钠、镁等活泼金属着火时.不能用泡沫灭火器灭火 | |
| C. | 生产水泥和玻璃均可用到碳酸钙 | |
| D. | 石英砂可用干生产粗硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.24 mol/(L•min) | B. | 0.08 mol/(L•min) | C. | 0.06 mol/(L•min) | D. | 0.12 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用3mL稀硫酸溶液与足量Zn反应,当气泡稀少时加入5mL浓硫酸,又迅速产生较多气泡,由上述操作及现象得出结论:硫酸浓度增大,产生H2的反应速率加快 | |
| B. | FeCl3+3KSCN?Fe(SCN)3(血红色)+3KCl,向溶液中加入KCl固体可快速看到血红色 | |
| C. | Ba(OH)2•8H2O与NH4Cl的反应是放热反应 | |
| D. | 化学反应中的能量变化,通常表现为热量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com