
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | 2Fe3++H2S═2Fe2++S↓+2H+ | ||
| C. | I2+SO2+2H2O═2I-+SO42-+4H+ | D. | 2Br-+SO42-+4H+═Br2+SO2↑+2H2O |
分析 根据氧化还原反应中还原剂的还原性大于还原产物的还原性,可以判断氧化还原反应中物质的还原性强弱,同时也可以根据还原性的强弱反推氧化还原反应能否发生,通过逐一判断反应中的还原剂和还原产物,与题目中的还原性强弱顺序表,符合的可以发生,不符合的不可以发生来解题.
解答 解:A、根据反应得出还原性强弱是:SO2>Fe2+,和题干的还原性强弱吻合,所以A能发生,故A不选;
B、根据反应得出还原性强弱是:Fe2+<H2S,和题干的还原性强弱吻合,所以B能发生,故B不选;
C、根据反应得出还原性强弱是:I-<SO2,和题干的还原性强弱吻合,所以C能发生,故C不选;
D、根据反应得出还原性强弱是:Br->SO2,和题干的还原性强弱不吻合,所以D不能发生,故D选;
故选D.
点评 本题考查学生氧化还原反应的基本概念和氧化性还原性强弱的判断规律,侧重于基础知识的考查,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 相关微粒浓度关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液所含阴阳离子的总数依次减小 | |
| C. | 三种溶液均加水稀释到1000mL,pH分别变为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
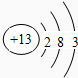 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入少量的SO2:SO2+OH-═HSO3- | |
| B. | 向氯水中通入少量的SO2:Cl2+SO2+2H2O═4H++2Cl-+SO42- | |
| C. | 将SO2通入到饱和的NaHCO3溶液中:2H++CO32-═H2O+CO2↑ | |
| D. | 将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+═BaSO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
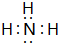 .
.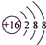 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
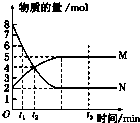 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com