

| A. | 电解硫酸或酸式硫酸盐溶液,阳极反应为2SO42--2e-═S2O82- | |
| B. | S2O82-具有强氧化性,H2S2O8是二元强酸 | |
| C. | 减压蒸馏的目的是为了减少H2O2分解,蒸馏得到的另一组分可循环利用 | |
| D. | 由溶液A转化为溶液B发生了氧化还原反应 |
分析 用惰性电极电解60%的硫酸溶液,得到溶液A中含有H+、S2O82-存在-O-O-键,S元素化合价仍为+6价,但O元素化合价为-1价,说明SO42-被氧化,为电解池的阳极反应,由溶液A生成B溶液生成H2O2、H+、SO42-,S2O82-发生水解反应生成SO42-,同时生成H2O2,减压蒸馏,可得到H2O2的浓溶液,以此解答该题.
解答 解:A.阳极发生氧化反应,SO42-被氧化,电极方程式为2SO42--2e-═S2O82-,故A正确;
B.S2O82-存在-O-O-键,具有强氧化性,A中含有H+、S2O82-,说明H2S2O8是二元强酸,故B正确;
C.过氧化氢不稳定,易分解,减压蒸馏可减小沸点,避免分解,蒸馏得到的另一组分含有H+、SO42-,可循环利用,故C正确;
D.由溶液A转化为溶液B,S2O82-水解反应SO42-和H2O2,为非氧化还原反应,故D错误.
故选D.
点评 本题考查物质的制备以及分离,为高频考点,侧重考查学生的分析能力和实验能力,注意把握电解的规律和应用,易错点为D,注意S2O82-存在-O-O-键,S2O82-水解反应SO42-和H2O2,为易错点,难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | NH4Cl受热易分解,可用作氮肥 | |
| C. | MgO熔点高,可用作耐高温材料 | |
| D. | KAl(SO4)2•12H2O易溶于水,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
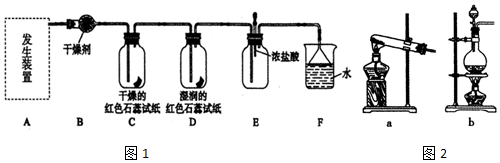
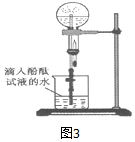
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 12g 12C含中子数为NA | |
| B. | 标准状况下,22.4L氖气中含有原子数为2NA | |
| C. | 28g CO和N2混合气体含有的原子数为2NA | |
| D. | 2mol钠与足量O2完全反应生成Na2O2时失去电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构为如图所示,这种有机物不可能具有的性质是( )
某有机物的结构为如图所示,这种有机物不可能具有的性质是( )| A. | ①④ | B. | 只有⑤ | C. | ②⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


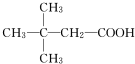 .(用结构简式表示)
.(用结构简式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27 | B. | 5.4 | C. | 10.8 | D. | 16.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com