
| 元素 | 原子结构和性质 |
| X | X原子在短周期中原子半径最大(稀有气体除外) |
| Y | 基态原子有3个不同的能级,各能级中电子数相等 |
| Z | 其气态氢化物与其最高价氧化物的水化物化合生成离子化合物 |
| W | 原子核外s能级电子总数等于p能级电子总数,能形成W2和W3两种单质 |
| T | 地壳含量最高的金属元素 |
| R | R的一种阳离子遇苯酚溶液显紫色 |
 ,故答案为:
,故答案为: ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、“碳纳米泡沫”与石墨互为同位素 |
| B、把“碳纳米泡沫”分散到适当的溶剂中,能产生丁达尔现象 |
| C、“碳纳米泡沫”是一种新型的碳化合物 |
| D、“碳纳米泡沫”和金刚石的性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
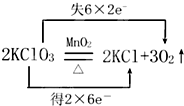 回答下列各题:
回答下列各题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2 |
| 红磷(少量) |
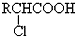 ;
;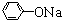 +RCl→NaCl+
+RCl→NaCl+

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在1 000℃时,此反应能自发进行 |
| B、在1 000℃时,此反应不能自发进行 |
| C、该反应能自发进行的最低温度约为730℃ |
| D、该反应能自发进行的最高温度约为730 K |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com