
分析 氯化铵溶液中,铵根离子部分水解生成一水合氨和氢离子,溶液显示酸性;加入明矾溶液后,铝离子水解抑制了铵根离子的水解,溶液中铵根离子的浓度增大.
解答 解:氯化铵溶液中,铵根离子发生水解:NH4++H2O?NH3•H2O+H+,溶液呈酸性;
明矾电离出的铝离子发生水解Al3++3H2O?Al(OH)3+3H+,则加入明矾后溶液中氢离子浓度增大,抑制了铵根离子的水解,导致溶液中铵根离子浓度增大,
故答案为:NH4++H2O?NH3•H2O+H+;增大.
点评 本题考查了盐的水解原理原理及其应用,题目难度不大,明确盐的水解原理及其影响因素为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
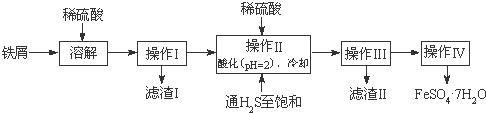
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g氦气所含原子数为NA | |
| B. | 1molD2O所含电子数为12NA | |
| C. | 0.1mol单质铝与足量盐酸反应转移的电子数为0.3NA | |
| D. | 标准状况下,1L水所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 的硫酸钾溶液中K+数为2NA | |
| B. | 3.2g氧气所含的原子数为0.2NA | |
| C. | 标准状况下,22.4L氢气所含质子数是2NA | |
| D. | 常温常压下,32g O2和32g O3所含氧原子数都是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做钠盐溶液的焰色反应时,用铂丝蘸取溶液放在酒精灯火焰上灼烧 | |
| B. | 分液时,下层液体先从分液漏斗下口放出,换一个接收容器,再将上层液体从分液漏斗下口放出 | |
| C. | 浓NaOH溶液沾到皮肤上,先用稀硫酸冲洗,再用水冲洗 | |
| D. | 用氨水清洗做过银镜反应的试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
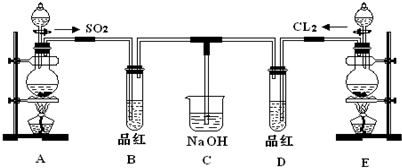
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com