
A、CS2的比例模型: |
B、铍原子最外层的电子云图: |
C、乙醇的球棍模型: |
D、氮原子最外层轨道表示式: |
 ,故A正确;
,故A正确;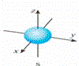 ,故B错误;
,故B错误; 中含有4个氢原子,而乙醇分子中含有6个氢原子,所以乙醇的球棍模型为:
中含有4个氢原子,而乙醇分子中含有6个氢原子,所以乙醇的球棍模型为: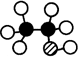 ,故C错误;
,故C错误;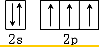 ,故D错误;
,故D错误;

科目:高中化学 来源: 题型:
| A、用Na2CO3溶液作洗涤剂:CO-23+H2O?HCO-3+OH- | ||||
B、用氯气给自来水消毒:Cl2+H2O
| ||||
| C、电解饱和食盐水制烧碱:2Cl-+2H2O═Cl2↑+H2↑+2OH- | ||||
| D、Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+=2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Cu除去FeCl2溶液中少量的FeCl3杂质:Cu+2Fe3+═Cu2++2Fe2+ |
| B、工业上用NO2与水反应制取HNO3:3NO2+H2O═NO3-+NO+2H+ |
| C、用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O |
| D、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、2g H2所含有的原子数目是NA |
| C、18g H2O在标准状况下的体积是22.4L |
| D、在标准状况时,20mL NH3与60mL O2所含的分子个数比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①=③>②=④ |
| B、③>①>④>② |
| C、①=③>④>② |
| D、②>④>③>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com