
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH浓溶液,加热,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 溶液X中有NH4+ |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成红色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 常温下,将铜放入浓硫酸中 | 无明显变化 | 铜在冷的浓硫酸中钝化 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.润的红色石蕊试变蓝,说明反应生成的是氨气,则原溶液中含有铵根离子;
B.过氧化钠具有强氧化性,能使有色物质褪色;
C.反应生成四氧化三铁和氢气;
D.水蒸气与铁粉反应生成四氧化三铁,四氧化三铁为黑色固体.
解答 解:A.向溶液X中滴加NaOH浓溶液,加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,说明生成气体为氨气,则溶液X中含有NH4+,故A正确;
B.过氧化钠具有强氧化性,能使有色物质褪色,过氧化钠和水反应生成NaOH导致溶液呈碱性,紫色石蕊试液遇碱变蓝色,所以溶液先变蓝色后褪色,故B错误;
C.反应生成四氧化三铁和氢气,粉末不会变红,现象不合理,故C错误;
D.将水蒸气通过灼热的铁粉,生成的是黑色的四氧化三铁,该实验现象不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,题目难度中等,涉及氨气的制备及检验、铁的性质、过氧化钠的性质等知识,侧重实验操作及实验原理的考查,注意实验方案的可行性、操作性及评价性的分析.


科目:高中化学 来源: 题型:实验题
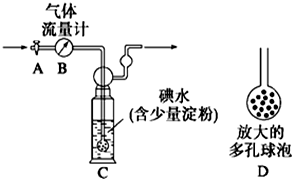
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的氯化钠制取钠 | B. | 用一氧化碳还原氧化铁制取铁 | ||
| C. | 加热分解氧化汞制取汞 | D. | 铁与硫酸铜溶液反应制取铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的质量相等 | |
| B. | 每升溶液中溶质的质量相等 | |
| C. | 相同体积的溶液,其溶质的物质的量相等 | |
| D. | 每升溶液中溶质的微粒数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
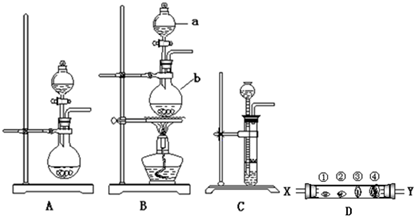
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 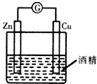 形成原电池 | B. | 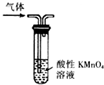 除去乙烯中混有的SO2 | ||
| C. | 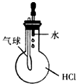 验证HCl气体在水中的溶解性 | D. | 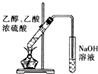 实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
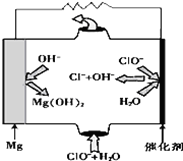 镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 该电池的总反应为:Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| C. | 电池工作时,正极周围溶液的碱性将不断减弱 | |
| D. | 电池工作时,OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
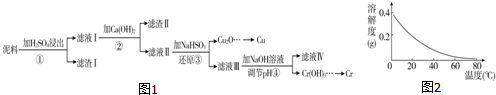
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com